Explicamos o que são alcenos e as propriedades físicas e químicas que apresentam. Além disso, quais são suas características e exemplos.
O que são alcenos?
Um tipo de hidrocarbonetos insaturados (que perderam os hidrogênios ligados aos átomos de carbono adjacentes) são conhecidos como alcenos em cujas moléculas é possível encontrar ligações duplas carbono-carbono.
Alcenos ou compostos olefínicos são substâncias orgânicas que, juntamente com alcanos (ou parafinas), alcinos (ou compostos acetilênicos) e cicloalcanos, constituem hidrocarbonetos alifáticos, isto é, aqueles que não são aromáticos (derivados principalmente de benzeno / C 6 H 6 ).
Por sua vez, os hidrocarbonetos alifáticos podem ser classificados como lineares, monocíclicos (um único anel composto por átomos de carbono) e policíclicos (com vários anéis ligados), portanto, podem haver alcenos pertencentes a todas as classificações.
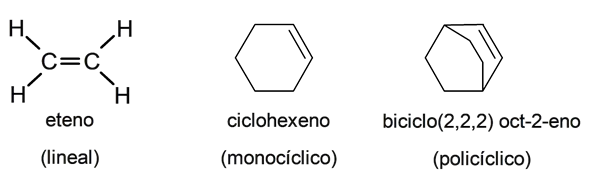
Veja também: Metais alcalinos
Nomenclatura de alcenos
Os alcenos eram anteriormente chamados de “olefinas” porque seus representantes mais simples, como o eteno, reagiam com halogênios para produzir óleos.
De acordo com a nomenclatura sistemática, esses compostos são nomeados usando a mesma regra dos alcanos. A cadeia de carbono mais longa que contém a ligação dupla é pesquisada. No caso de haver mais de uma ligação dupla, procura-se a cadeia que possua a menor combinação das posições dessas ligações duplas. Se a molécula tem substituintes, eles são nomeados colocando-se o prefixo numérico que corresponde à posição do carbono ao qual estão ligados (1,2,3 …), mas se tiver vários substituintes iguais, o prefixo (di , tri, tetra ..) dependendo se são dois, três ou quatro.
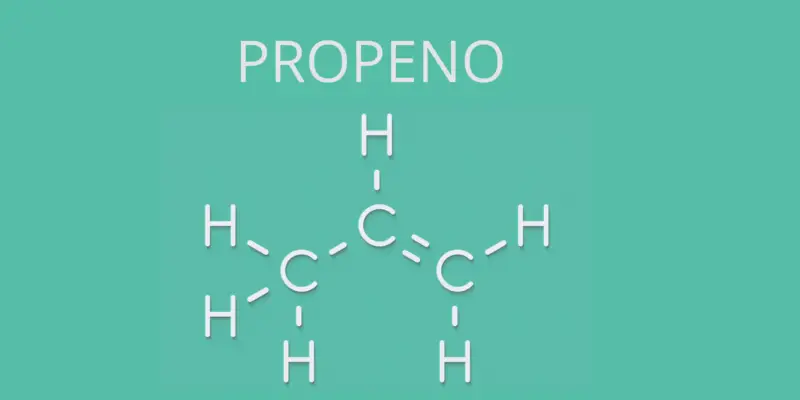
No entanto, muitos alquenos são conhecidos por seu nome não sistemático (como é frequentemente o caso com hidrocarbonetos) e, nesse caso, a terminação oficial (-eno) é substituída por -ileno, como é o caso do eteno, também chamado de etileno, ou com o propeno, denominado propileno.
Por outro lado, se houver mais de uma ligação dupla, as terminações -dieno (duas ligações duplas) ou -trieno (três ligações duplas), etc. são usadas respectivamente .
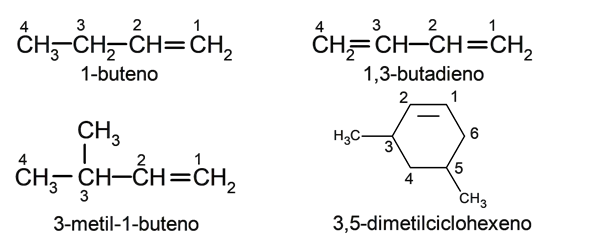
Fórmula geral de alcenos
A fórmula geral para os alcenos lineares é C n H 2n , onde n representa o número dos seus respectivos átomos de carbono . Isso significa que para cada nova ligação dupla haverá dois átomos de hidrogênio a menos do que os indicados nesta fórmula.
Diferença com alcanos e alcinos

Alcenos diferem de alcanos e alcinos na ligação dupla que aparece entre seus átomos de carbono . Na verdade, costuma-se dizer que um alceno é um alcano que perdeu átomos de hidrogênio, liberando dois elétrons que constituem a segunda ligação de cada ligação dupla.
Alcanos têm uma ligação simples entre seus carbonos (CC) ; os alcenos têm pelo menos uma ligação dupla (C = C) e os alcinos pelo menos uma ligação tripla (C≡C).
Propriedades físicas de alcenos
Alcenos têm as seguintes propriedades físicas:
- Dependendo do número de átomos de carbono, os alcenos podem ser gases (menos átomos) ou líquidos (mais átomos).
- Eles são insolúveis em água, mas solúveis em éter, clorofórmio ou benzeno.
- Eles são menos densos que a água.
- Eles têm alguma ou nenhuma polaridade molecular, dependendo da geometria de cada molécula em torno da ligação dupla.
- Eles têm uma acidez maior do que os alcanos correspondentes, um produto da polaridade da ligação.
- Seu ponto de ebulição e fusão não variam muito em relação aos alcanos correspondentes.
Propriedades químicas de alcenos

Os alcenos são caracterizados por uma alta reatividade química com respeito aos alcanos e suas reações são majoritárias de adição. As reações mais frequentes são:
- Adição de halogenetos de hidrogênio . Reação com HCl ou HBr.

- Halogenação . Reação com halogênios (Cl 2 , Br 2 ).
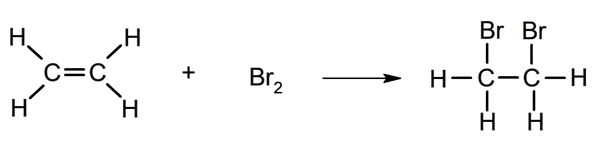
- Polimerização . Vital na indústria do petróleo e seus derivados, uma vez que se alcançam longas e resistentes cadeias de matéria maleável ( plásticos ).

Abundância de alcenos
Os alcenos são muito menos abundantes do que os alcanos ; na verdade, eles são encontrados no petróleo natural, mas como um componente muito menor.
Os processos de craqueamento de óleo, por outro lado, são uma fonte importante de alcenos utilizáveis para a indústria. No entanto, os alcenos são comuns na química orgânica e fazem parte das reações comuns aos seres vivos , especialmente plantas e vegetais.
Síntese de alcenos
As reações que geram alcenos como resultado e que, portanto, podem ser usadas para sintetizá-los são:
Desidrohalogenação .
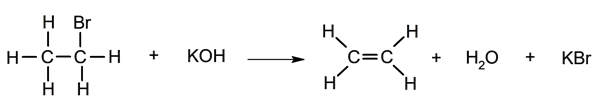
Desalogenação .
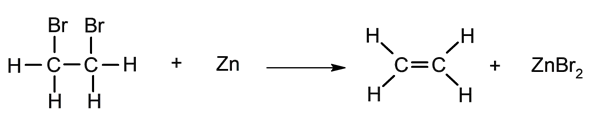
Eliminação da água dos álcoois .
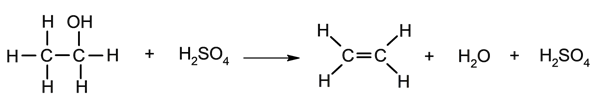
Pirólise .
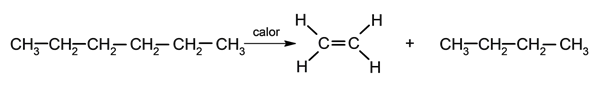
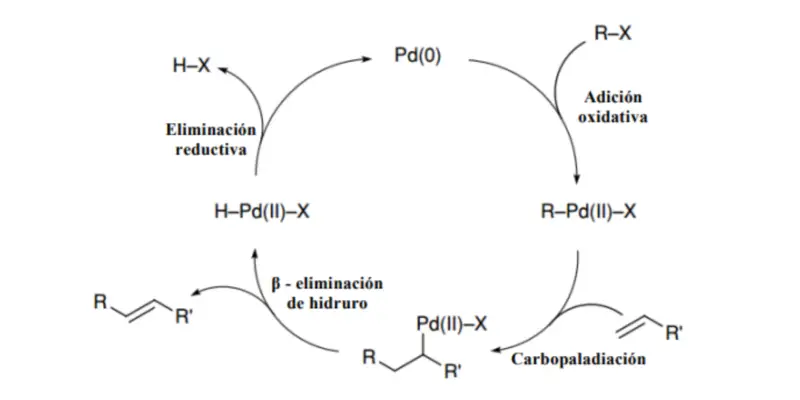
Também podem ser obtidos como resultado da reação de Chungaev e da reação de Grieco, pela formação de ligações carbono-carbono (reação de Wittig, olefinação de Julia, etc.), por reações pericíclicas ou reações de acoplamento com metais (reação de Suzuki, reação de Heck).
Dienos e polienos
Se houver mais de uma ligação dupla na molécula, >dieno (duas ligações), um trieno (três ligações) ou um polieno (ligações múltiplas).
Esses compostos, no entanto, carecem de propriedades especiais e se comportam como alcenos normais , exceto que exibem reatividades muito particulares, dependendo da localização das ligações duplas múltiplas na molécula.
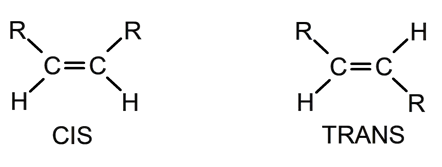
Estabilidade de alcenos
Os alcenos são mais ou menos estáveis, dependendo de onde a ligação dupla está localizada na molécula . Os alcenos internos, cuja dupla ligação está localizada na parte central da molécula, são muito mais estáveis do que aqueles com dupla ligação localizada nas extremidades. Desta forma, os isômeros trans são mais estáveis do que os cis .
Exemplos de alcenos
Alguns alcenos comuns são:
- Eteno (CH 2 = CH 2 )
- Propeno (CH 2 = CH-CH 3 )
- 1-buteno (CH 2 = CH-CH 2 -CH 3 )
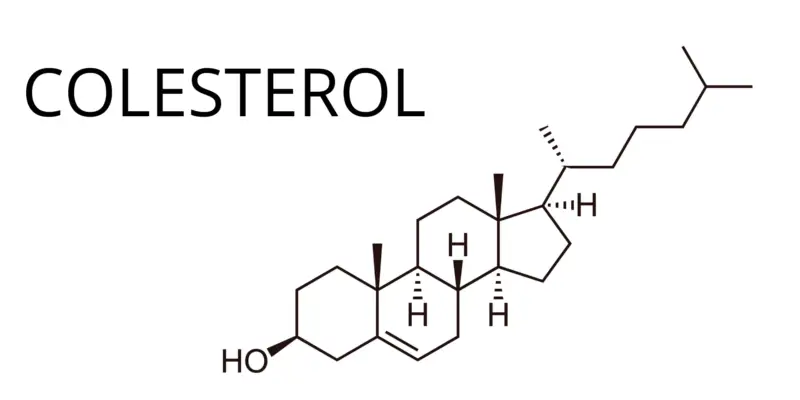
- Colesterol (C 27 H 46 O 6 )
- Lanosterol (C 30 H 50 O)
- Cânfora (C 10 H 16 O)
- Mirceno (C 10 H 16 )
Pode servir para você: Polímeros