Explicamos o que é carbono, por que esse elemento é tão importante para a vida e quais são suas principais características.

Qual é o átomo de carbono?
O carbono é um dos elementos mais abundantes da Terra , essenciais para a vida . É o principal componente da matéria orgânica; também integra o produto final do metabolismo da maioria dos seres vivos e do processo de combustão, uma vez que faz parte do dióxido de carbono (CO 2 ).
O carbono ocorre sob várias estruturas e também de forma amorfa ; suas propriedades físicas costumam ser muito contrastantes. Tem a propriedade de poder combinar-se com quase todos os elementos ; Pode ser combinado com metais e não metais (exemplos: carboneto de cálcio (CaC 2 ), dissulfeto de carbono (CS 2 ), clorofórmio (CHCl 3 ), etc.).
Cerca de 10 milhões de compostos de carbono são estimados , muitos deles essenciais para a vida no planeta.
Veja também: Química Orgânica
Características do átomo de carbono

- Seu número atômico é 6 e sua massa atômica é 12 . Isso significa que ele possui 6 prótons e 6 nêutrons em seu núcleo em sua configuração estável, e que o núcleo é circundado por 6 elétrons. Esses elétrons são distribuídos de acordo com a seguinte configuração eletrônica: dois em seu primeiro nível de energia (que possui um orbital s) e quatro em seu segundo nível de energia (que possui os orbitais se p), isto é representado como 1s 2 2s 2 2p 2 .
- É tetravelente . Isso significa que ele tem 4 elétrons orbitando em seu último nível de energia, que podem se combinar com os elétrons mais externos de outros átomos , geralmente de carbono também, formando ligações covalentes . Isso significa que o carbono pode formar quatro ligações químicas .
- Apresenta alotropia . Pode ocorrer sob diferentes estruturas moleculares, no mesmo estado físico, dependendo das condições de formação. Os alótropos mais importantes do carbono são: diamante, grafite, lonsdaleita, fulereno, nanotubo de carbono, carbono amorfo e grafeno.
- Apresenta isótopos . O carbono possui apenas dois isótopos naturais: carbono-12, que é a maioria (98,90%), e carbono-13, presente em proporção mínima (1,10%). Além disso, existem treze isótopos instáveis cuja meia-vida ou meia-vida varia de 200 nanossegundos (como no carbono-22) a 5730 anos (como no carbono-14). O carbono-13 é usado em estudos estruturais (especialmente RMN / Ressonância Magnética Nuclear), o carbono-14 é usado para datar objetos arqueológicos, devido à sua meia-vida muito longa.
- É facilmente combinado . O carbono pode combinar-se com metais e não metais (por exemplo: carboneto de cálcio (CaC 2 ), dissulfeto de carbono (CS 2 ), clorofórmio (CHCl 3 ), etc.). Estima-se que existam cerca de 10 milhões de compostos de carbono, muitos deles essenciais para a vida.
Hibridizações de carbono
Orbitais atômicos são as probabilidades de encontrar um elétron em uma região do espaço ao redor do núcleo atômico. A hibridização é a interação entre esses orbitais, que quando sobrepostos formam orbitais híbridos que levam à formação de diferentes ligações químicas.
No caso do carbono, seus quatro elétrons da camada mais externa podem se combinar com elétrons de outros átomos, portanto, o átomo de carbono pode formar três tipos de hibridizações , que têm implicações na geometria molecular final dos compostos que forma. Essas hibridizações podem ser:
- Hibridização Sp 3 . Explique a formação e a geometria de compostos com ligações simples, que têm uma geometria em forma de tetraedro.
- Hibridização Sp 2 . Explique a formação e a geometria de compostos com ligações duplas, que podem ter geometria trigonal plana.
- Hybridization sp . Explique a formação e a geometria dos compostos de ligação tripla, que possuem geometria linear.
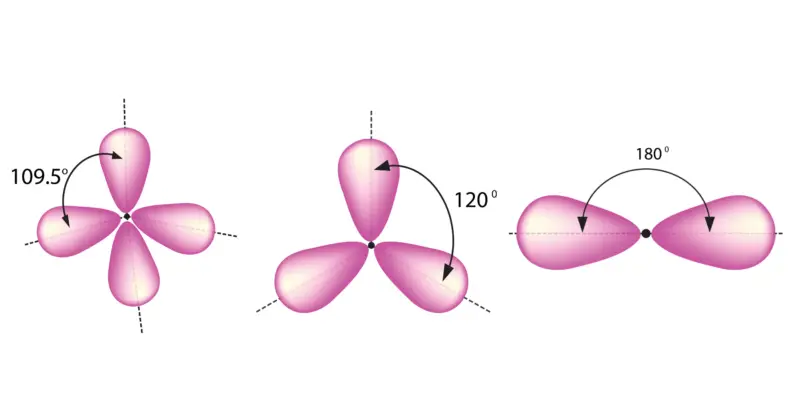
Geometria molecular de acordo com o tipo de hibridação. Da esquerda para a direita: sp 3 , sp 2 e sp.
Três configurações possíveis
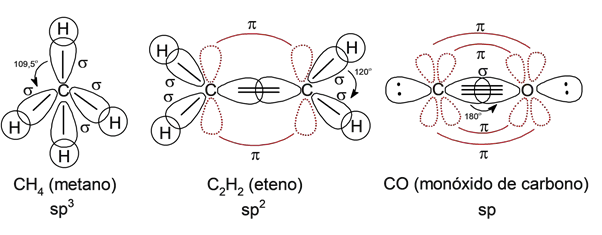
Uma vez que o tipo de ligação (determinado pelo tipo de hibridização) determina o ângulo de ligação, por sua vez, existem três geometrias moleculares possíveis quando o carbono participa da formação de uma ligação química:
- A ligação simples determina a formação de um tetraedro, com ângulos de 109,5 °.
- A dupla ligação determina a formação de uma estrutura triangular plana, com ângulos de 120 °.
- A ligação tripla determina a formação de uma estrutura linear, com ângulos de 180 °.
Reatividade de carbono
- Os compostos feitos de carbono com ligações múltiplas (duplas ou triplas) entre os átomos de carbono são mais reativos do que aqueles com ligações simples.
- O carbono reage com o hidrogênio para formar hidrocarbonetos .
- É combustível.
- O carbono reage com o oxigênio para formar principalmente dióxido de carbono (CO 2 ) e monóxido de carbono (CO).
Semelhança relativa ao silício
Carbon é o primeiro membro do grupo IVA dentro da Tabela Periódica dos Elementos. É seguido neste mesmo grupo pelo silício (Si), que também possui 4 elétrons em sua camada mais externa, mas em um nível de energia mais alto.
No entanto, o silício não pode formar ligações múltiplas silício-silício devido à repulsão gerada por um maior número de elétrons internos, o que significa que os átomos não podem se aproximar o suficiente. Por outro lado, ambos os elementos não são metálicos e são sólidos à temperatura ambiente.
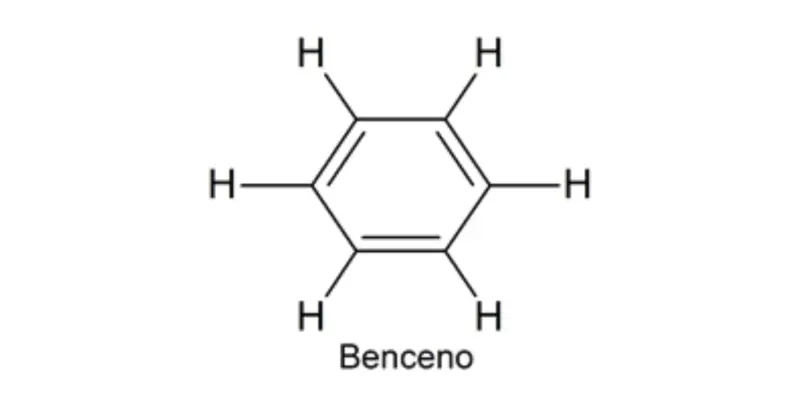
Kekulé e os fundamentos da química orgânica
O químico alemão August Kekulé postulou em 1858 uma teoria estrutural que permitia explicar o fenômeno de ressonância do benzeno. Ele propôs que o benzeno é composto de 6 átomos de carbono e 6 átomos de hidrogênio , mas os átomos de carbono são organizados na forma de um ciclo e as ligações entre eles alternam entre simples e duplas. Isso foi fundamental como um antecedente para o conceito de ligação covalente introduzido por Lewis, que serve como base para a compreensão da química do carbono em geral.
Siga com: Alquenos