Explicamos o que são os elementos químicos, como se originaram e sua classificação. Além disso, quais são suas características e alguns exemplos.

Quais são os elementos químicos?
Elemento químico é referido o material de que é composto de um tipo de átomo , isto é, que é atomicamente puro. São substâncias que não podem ser decompostas em outras mais simples por meio de reações químicas e que são classificadas na tabela periódica dos elementos químicos.
Os elementos não devem ser confundidos com substâncias simples , pois em certos casos dois ou mais átomos do mesmo tipo podem ser agrupados de forma diferente. Por exemplo, a partir de átomos de oxigênio (O) podem ser compostas duas substâncias simples: ozônio (O 3 ) e oxigênio molecular (O 2 ).
A maioria dos elementos conhecidos vem da natureza , onde podem ser encontrados monatomicamente ou formando compostos com outros elementos. Alguns até existem em forma artificial, devido à inventividade do homem.
Dependendo do elemento que for, terá certas propriedades e, portanto, diferentes usos e aplicações.
Nem os elementos químicos devem ser confundidos com os “quatro elementos” ( água , fogo , ar , terra ), que respondem a uma antiga classificação das forças envolvidas na natureza.
Veja também: Separação de misturas
Origem dos elementos químicos
Os elementos químicos são formados, até onde sabemos, dentro das estrelas como produto de processos complexos de fusão e fissão atômica que geram elementos cada vez mais pesados em um processo denominado nucleossíntese .
Supomos que é assim que toda a matéria do universo teria se originado , exceto aquela que os seres humanos foram capazes de criar por conta própria em nossos laboratórios e reatores nucleares.
Nomenclatura e representação de elementos químicos

Os elementos químicos costumam ser batizados com nomes da tradição mitológica greco-romana , como mercúrio , já que muitas das teorias sobre a origem e a essência do universo que manejamos durante séculos vêm dessas culturas .
Em outros casos, entretanto, um nome derivado do sobrenome de seu descobridor é normalmente dado , como no caso de Lawrence, em homenagem à equipe de físicos do Laboratório Nacional Lawrence Berkeley que o sintetizou pela primeira vez.
Os elementos químicos são representados por uma ou uma combinação de letras (siglas) , que resumem o nome completo do átomo, por exemplo: oxigênio (O), mercúrio (Hg) e lawrencium (Lr).
Abundância de elementos químicos
Existem atualmente 118 elementos químicos conhecidos , entre naturais e artificiais. Os primeiros tendem a >ferro , raramente no estado puro). Isso dependerá da reatividade do elemento e de suas afinidades características.
Os elementos artificiais são geralmente instáveis e freqüentemente liberam quantidades de energia e matéria (radioatividade) que são perigosas para a saúde. Esse processo de decomposição pode levar frações de segundo, como no caso do oganeson (Og), ou pode levar centenas e até milhões de anos, como no caso do plutônio (Pu).
Tabela periódica
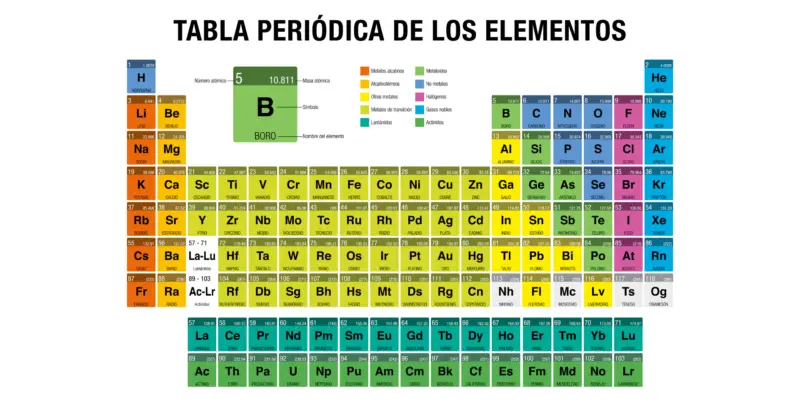
A tabela periódica dos elementos foi criada por Dmitri Mendeleev em 1869 , para ordenar visualmente os elementos químicos conhecidos com base em suas propriedades e características.
Hoje, após inúmeras atualizações e modificações, estamos utilizando uma nova versão contendo os elementos recentemente sintetizados e servindo como uma ferramenta para o estudo atômico da natureza.
Classificação de elementos químicos
Os elementos químicos podem ser classificados com base em suas propriedades, conforme distinguidos e organizados pela tabela periódica. Nesse sentido, falamos sobre:
- Metais . São elementos sólidos à temperatura ambiente (exceto mercúrio), densos e muito bons condutores de calor e eletricidade. Geralmente são brilhantes, ou seja, refletem luz . Eles são classificados, por sua vez, em actinídeos, lantanídeos, metais de transição, alcalinos , alcalino-terrosos e outros metais.
- Sem metais . São elementos que não são bons condutores de calor ou eletricidade e são muito fracos para serem laminados ou esticados como ocorre com os metais. Na maior parte, eles são essenciais para os sistemas biológicos (compostos orgânicos).
- Metalóides . São elementos que correspondem a uma classificação intermediária entre metais e não metais, e que atendem às características de ambos os grupos. Eles são conhecidos como semimetais.
- Halogênios . É um grupo de seis elementos que tendem a formar moléculas diatômicas muito ativas quimicamente, devido à sua eletronegatividade: geralmente formam íons mononegativos (moléculas eletricamente carregadas). Os halogênios são altamente oxidantes, então esses elementos costumam ser cáusticos e corrosivos.
- Gases nobres . É um grupo de sete elementos cujo estado natural é o gás . Existem, geralmente, em sua forma monoatômica de baixíssima reatividade e por isso são também conhecidos como gases inertes. Eles compartilham a maioria de suas propriedades físicas e são extremamente estáveis.
Número atômico

O número atômico é um número representado pela letra Z que indica o número de prótons encontrados no núcleo dos átomos de um elemento. Na Tabela Periódica, geralmente é apresentado na parte superior esquerda da caixa de cada elemento.
Essa informação é muito importante na química e na física quântica: lembre-se que os prótons têm carga positiva e os elétrons têm carga negativa , então o número atômico serve para entender (junto com o número de elétrons) o comportamento eletromagnético dos átomos.
Massa atômica
A massa de um átomo é equivalente à soma do número de partículas em seu núcleo : prótons e nêutrons.
Uma vez que um elemento químico tem vários isótopos (átomos do mesmo elemento químico que têm diferentes números de nêutrons) com diferentes massas atômicas, a massa atômica de um elemento é geralmente calculada como a média de todos os seus isótopos conhecidos.
No entanto, hoje se sabe que esse procedimento não é inteiramente correto porque se o elemento tivesse um de seus isótopos na grande maioria, a massa calculada como uma média se referiria principalmente à massa do isótopo majoritário. A maneira estrita de calcular a massa de um átomo é calcular a massa do isótopo de interesse e não pela média da massa de todos os isótopos.
Valencia

Valência é o número de elétrons que um átomo de um elemento pode ceder ou aceitar para completar sua órbita externa (último nível de energia).
Com base nisso, o átomo pode formar ligações covalentes , iônicas ou metálicas, compartilhando ou transferindo esses elétrons com outro átomo. Alguns átomos têm mais de uma valência, então esse conceito é frequentemente preferido para ser chamado de “número de oxidação”.
Isótopos

Os átomos de um mesmo elemento podem variar entre si, de acordo com suas propriedades nucleares e energéticas. Eles são chamados de isótopos para os átomos de um elemento químico se comportarem de maneira diferente em relação ao seu núcleo. Isótopos são átomos diferentes do mesmo elemento químico, mas que têm o mesmo número de prótons e número diferente de nêutrons em seu núcleo.
Por exemplo, o plutônio é um elemento radioativo, cujo isótopo plutônio-238 acaba se transformando em chumbo -206 ; mas seu isótopo de vida mais longa é o plutônio-244, com meia-vida (o tempo que leva para um núcleo se desintegrar) de 80 milhões de anos. Em contraste, o plutônio-239 dura cerca de 24.100 anos e o plutônio-238 dura apenas 88 anos.
Exemplos de elementos químicos
Os elementos químicos mais conhecidos são:
- Oxigênio (O)
- Carbono (C)
- Hidrogênio (H)
- Nitrogênio (N)
- Enxofre (S)
- Ferro (Fe)
- Cobre (Cu)
- Ouro (Au)
- Prata (Ag)
- Mercúrio (Hg)
- Zinco (Zn)
- Hélio (He)
- Fósforo (P)
- Silício (Si)
- Sódio (Na)
- Lítio (Li)
- Cálcio (Ca)
- Platina (Pt)
- Níquel (Ni)
- Cloro (Cl)
- Argônio (Ar)
- Urânio (U)
- Flúor (F)
- Potássio (K)
- Neon (Ne)
- Arsênico (As)
- Cromo (Cr)
Pode ajudá-lo: Compostos orgânicos