Explicamos o que são gases ideais, sua classificação e propriedades que apresentam. Além disso, suas características gerais e para que servem.
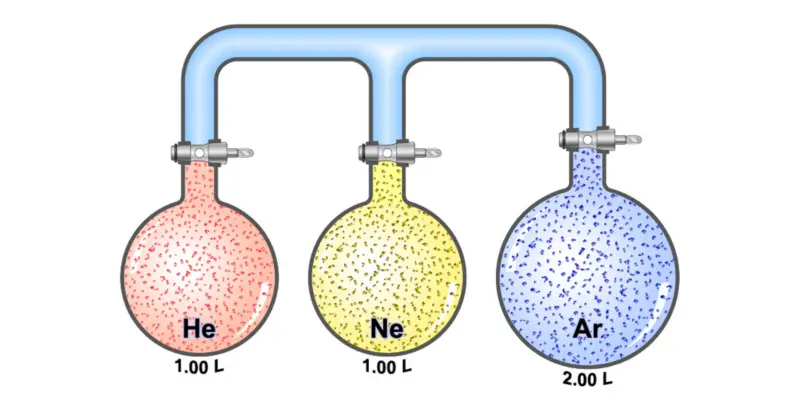
Quais são os gases ideais?
Os gases ideais são chamados de gases hipotéticos ou teóricos, ou seja, imaginários , que seriam compostos por partículas que se movem aleatoriamente e sem interagir umas com as outras.
É um conceito útil para o uso da mecânica estatística , por meio de uma equação de estado simplificada conhecida como Lei dos Gases Ideais.
Muitos dos gases reais conhecidos em química se comportam à temperatura e pressão ambientes como um gás ideal, pelo menos de uma perspectiva quantitativa. Isso permite que eles sejam estudados como gases ideais dentro de certos parâmetros razoáveis.
No entanto, o modelo de gás ideal tende a falhar à medida que as condições de temperatura e pressão variam , uma vez que o tamanho intermolecular e a interação são importantes nessas condições.
No entanto, este modelo não é adequado para gases pesados.
Veja também: Fluidos
Tipos de gás ideais
Existem três tipos básicos de gases ideais, de acordo com o tipo de foco físico escolhido para sua abordagem:
- Gás Maxwell-Boltzmann ideal. É classificado por sua vez em gás ideal termodinâmico clássico e gás ideal quântico, dependendo da abordagem física aplicada em seu estudo.
- Gás ideal quântico de Bose. Composto por bósons.
- Gás ideal quântico Fermi. Composto por fermions.
Como é definido um gás ideal?
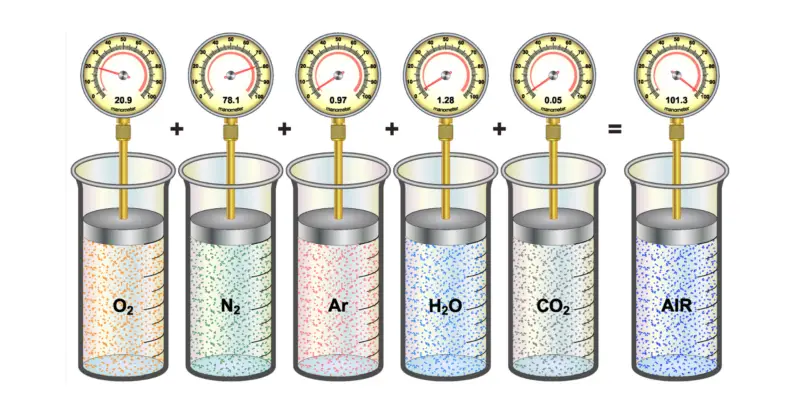
Um gás ideal, como já dissemos, é uma substância em estado gasoso cujas partículas são mantidas em número estável , sem efeitos eletromagnéticos.
Sua energia cinética é diretamente proporcional à temperatura . As colisões entre as moléculas que o compõem (entre si e com o recipiente ou recipiente) são elásticas, conservando o momento e a energia cinética.
Os gases reais se aproximam desse comportamento ideal apenas à temperatura e pressão ambiente, quando se trata de gases monoatômicos.
Propriedades dos gases ideais
As principais propriedades dos gases ideais são quatro:
- Eles sempre têm o mesmo número de moléculas
- Não existem forças de atração ou repulsão entre as moléculas.
- Não há colapso entre as moléculas ou mudanças em sua natureza física (mudanças de fase).
- As moléculas de gás ideais sempre ocupam o mesmo volume nas mesmas condições de pressão e temperatura.
Lei do gás ideal
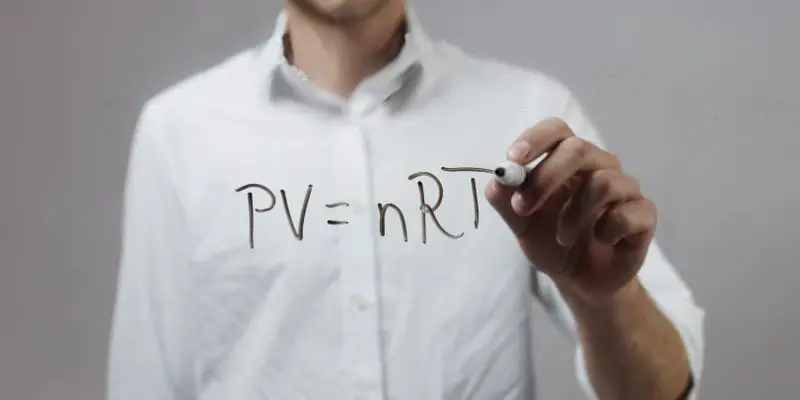
O estado de uma quantidade de matéria gasosa é formulado com base em quatro variáveis diferentes : pressão, volume, temperatura e número de moles de gás.
A relação matemática ideal entre esses fatores é precisamente a Lei do Gás Ideal, que prevê o comportamento da maioria dos gases reais à temperatura e pressão ambiente.
Esta lei permite que uma das quatro variáveis seja calculada a partir do conhecimento das outras três, de acordo com a fórmula que a expressa:
PV = nRT
P representa a pressão do gás, V o seu volume, n o número de moles do gás (que deve permanecer constante) , R a constante dos gases e T a temperatura do gás em questão.
Se um gás estiver em conformidade com esta lei, pode ser tratado como se fosse ideal .
Esta lei é também a combinação das leis de Boyle , Gay-Lussac, Charles e Avogadro.
Lei de Boyle
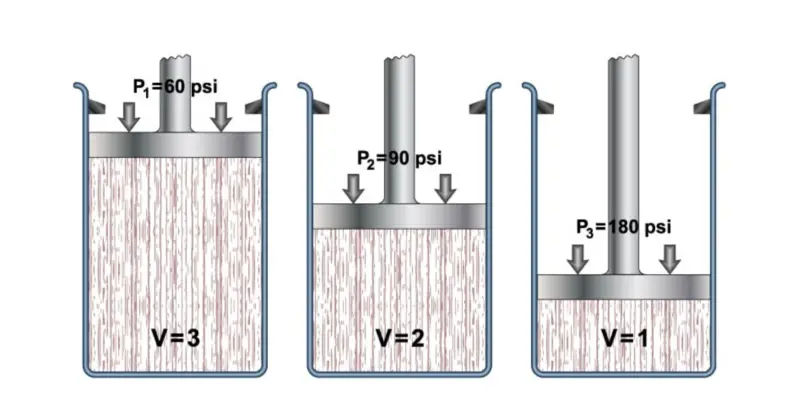
No século XVII, o cientista Robert Boyle realizou uma série de experimentos com gases e líquidos , graças aos quais determinou o efeito que a pressão exerce sobre o volume dos gases.
Isso o levou a formular sua Lei, que afirma que “o volume de um gás varia inversamente proporcional à pressão se a temperatura permanecer constante”.
Isso é formulado para gases ideais da seguinte forma: P1xV1 = P2xV2 , onde as variáveis com 1 são iniciais e as variáveis com 2 são finais.
Lei de Gay-Lussac
Essa lei explica que a pressão de uma massa de gás cujo volume permanece constante é diretamente proporcional à sua temperatura.
Para gases ideais, é formulado da seguinte forma: P1 / T1 = P2 / T2 , onde as variáveis com 1 são iniciais e as variáveis com 2 são finais.
Esta formulação foi levantada por Joseph Louis Gay-Lussac em 1808.
Charles Law
Graças aos estudos do francês Jacques Charles em 1787, temos esta Lei que expressa a relação constante entre a temperatura e o volume de um gás , quando a pressão é constante.
Este é formulado, para fins de gás ideal, como: V1 / T1 = V2 / T2.
Lei de Avogadro
Formulado em 1811 por Amadeo Avogadro , que descobriu que:
“Sob condições iguais de pressão e temperatura, as densidades relativas dos corpos gasosos são proporcionais aos seus números atômicos.”
Sua hipótese básica é que volumes iguais de diferentes substâncias gasosas, sob condições idênticas de pressão e temperatura, deveriam conter o mesmo número de partículas (moléculas ou átomos).
Para que servem os gases ideais?
A noção de gás ideal surge devido à necessidade de se entender o funcionamento desses fluidos , amplamente utilizados na indústria.
Em vez de criar um modelo para cada tipo de gás, utiliza-se uma formulação ideal , ou seja, um modelo para o qual direcionar os esforços.
Gases ideais e não ideais

Gases não ideais são gases reais , ou seja, aqueles que existem na vida real e cujo comportamento nem sempre segue o que a Lei dos Gases Ideais prevê.
Isso fica mais evidente no caso de gases pesados , como vapor d’ água ou CO 2 , que tendem a se comportar de acordo com seus próprios padrões. Em contraste, gases monoatômicos leves, como o hidrogênio, tendem a >