Explicamos o que são os gases, como são classificados e as propriedades que apresentam. Além disso, quais são suas características e exemplos.

O que são gases?
Com o termo gás, nos referimos a um dos três principais estados de agregação da matéria (junto com líquidos e sólidos ). É caracterizado pela dispersão, fluidez e pouca atração entre suas partículas constituintes.
Os gases são a forma mais volátil de matéria na natureza e são extremamente comuns na vida cotidiana.
Quando uma substância está no estado gasoso, normalmente a chamamos de gás ou vapor e sabemos que suas propriedades físicas foram alteradas. No entanto, as propriedades químicas não mudam : a substância ainda é composta dos mesmos átomos .
Para que as propriedades químicas mudem é necessário que seja uma mistura , já que forçar um de seus ingredientes a se transformar em gás é uma forma útil de separá-lo dos demais.
Os gases são encontrados em todos os lugares : desde a massa heterogênea de gases que chamamos de atmosfera e que respiramos como ar , aos gases que são gerados dentro do intestino, o produto da digestão e decomposição, aos gases inflamáveis com os quais alimentamos nossas cozinhas e fornos.
Veja também: Poluição do ar
História dos gases
A palavra gás foi inventada no século 17 pelo cientista flamengo Jan Baptista van Helmont , do termo latino caos (“caos”).
Ele escolheu o nome para o grau aparente de desordem exibido pelas moléculas de um gás. Também era conhecido na época como “estado aeriforme” , termo que caiu em desuso.
As primeiras leis sobre o comportamento dos gases foram consequência de seu intenso estudo no final do mesmo século, especialmente de suas relações entre pressão, temperatura e volume.
Isso levou Émile Clapeyron a formular a lei ideal para todos os gases (“Lei dos Gases Ideais”) em 1834.
Leis de gás
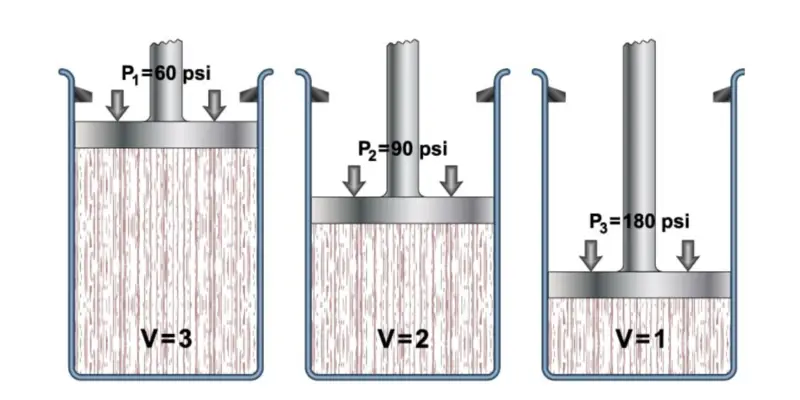
O comportamento dos gases é descrito pela Lei dos Gases Ideais , que por sua vez pode ser entendida como a união de outras leis:
- Lei de Boyle. “O volume de um gás varia inversamente proporcional à pressão se a temperatura permanecer constante.” É expresso de acordo com a fórmula: P1xV1 = P2xV2.
- Lei Gay-Lussac. Explique que a pressão de uma massa de gás cujo volume permanece constante é diretamente proporcional à sua temperatura. Isso é formulado da seguinte forma: P1 / T1 = P2 / T2.
- Charles Law. Expressa a relação constante entre a temperatura e o volume de um gás, quando a pressão é constante. Sua fórmula é: V1 / T1 = V2 / T2.
- Lei de Avogadro. “Sob condições iguais de pressão e temperatura, as densidades relativas dos corpos gasosos são proporcionais aos seus números atômicos.”
Tipos de gases
Os gases podem ser classificados de acordo com sua natureza química em:
- Combustível ou inflamável. Aqueles que podem queimar, ou seja, gerar reações explosivas ou exotérmicas na presença de oxigênio ou outros oxidantes.
- Corrosivo. Aquelas que, ao entrarem em contato com outras substâncias, as submetem a intensos processos de redução ou oxidação, gerando danos à sua superfície ou feridas no caso de serem matéria orgânica.
- Oxidante. Aqueles que permitem que uma chama ou uma reação inflamável se mantenha viva, pois induzem a combustão em outras substâncias.
- Tóxico Aqueles que representam um perigo para a saúde devido às reações que introduzem no corpo dos seres vivos , como os gases radioativos.
- Inerte ou nobre . Aqueles que apresentam pouca ou nenhuma reatividade, exceto em determinadas situações e condições.
- Ideais. Eles não são realmente gases, mas um conceito ideal e funcional de como os gases devem se comportar. Uma abstração.
Propriedades do gás

Os gases têm as seguintes propriedades:
- Intangível, incolor, insípido. A maioria dos gases é transparente, impossível de tocar e também carece de cor e sabor. Este último varia muito, entretanto, e muitos gases possuem um odor característico e até mesmo uma cor típica observável.
- Eles não têm seu próprio volume. Pelo contrário, ocupam o volume do contentor em que se encontram.
- Eles não têm forma própria. Eles também assumem isso de seu contêiner.
- Eles podem expandir e contrair. Assim como sólidos e líquidos, na presença de calor ou frio.
- Eles são fluidos . Muito mais que os líquidos, os gases praticamente não possuem forças de ligação entre suas partículas, podendo perder sua forma e passar de um recipiente para outro, ocupando todo o espaço disponível.
- Eles têm alta difusão. Os gases podem se misturar facilmente devido ao espaço entre as partículas que possuem.
- Eles são solúveis. Como os sólidos, os gases podem se dissolver na água ou em outros líquidos.
- Eles são muito compressíveis. Um gás pode ser forçado a ocupar um volume menor, forçando as moléculas a se estreitarem. É assim que o gás liquefeito (líquido) é obtido.
Sublimação de gás

A sublimação é um processo de mudança de fase física , que permite que um sólido seja convertido diretamente em gás, sem passar pela fase líquida.
Este processo é menos comum e geralmente envolve condições específicas de pressão e temperatura , mas podemos observá-lo em gelo seco (ou gelo de CO 2 ) em temperatura ambiente: o bloco sólido emite um leve vapor que nada mais é do que a substância recuperando seu original Estado gasoso.
Evaporação de gás
A evaporação é um processo de mudança de fase extremamente comum , que leva um líquido a se tornar um gás, por meio da adição de energia (calor).
Colocamos em prática todos os dias na cozinha , toda vez que fervemos água, por exemplo, ou no chuveiro quando a água muito quente se transforma em vapor observável como uma nuvem esbranquiçada.
Condensação de gás

A condensação é o processo oposto à evaporação, ou seja, um processo de mudança de fase que leva do estado gasoso ao líquido , devido à perda de energia térmica.
Essa energia perdida faz com que as partículas de gás vibrem mais lentamente , permitindo que se aproximem e se unam mais, como ocorre em vidros frios em um dia chuvoso, ou em plantas e outras superfícies com orvalho.
Sublimação reversa de gases
A sublimação reversa, como o próprio nome indica, é o caminho oposto da sublimação, ou seja, a passagem do estado gasoso ao sólido sem passar primeiro por um momento de liquidez.
Este processo requer condições muito específicas de pressão e temperatura.
Quando as substâncias puras no estado gasoso se solidificam em cristais , isso é chamado de cristalização. É o caso dos cristais de gelo que caem durante as nevascas.
Plasma

O estado plasmático da matéria é considerado um quarto estado de agregação , mas possui enormes semelhanças com os gases, pois é basicamente um gás ionizado.
Isso significa que é um gás cujas partículas perderam elétrons e adquiriram certa carga eletromagnética. Existem plasmas frios, como os usados em lâmpadas “lava” , ou plasmas quentes, como o fogo ao redor do sol .
Exemplos de gases

Alguns exemplos de gases são:
- Hidrogénio (H 2 ). O gás diatômico mais comum emtodo o universo .
- Hélio (He). Insípido, incolor e inerte. É o menos solúvel em água de todos os gases.
- Metano (CH 4 ). Hidrocarboneto gasoso de odor desagradável obtido como produto da decomposição orgânica.
- Air . Uma mistura heterogênea de hidrogênio, nitrogênio , oxigênio, argônio e outros gases que os seres vivos respiram.