Explicamos o que são os hidrocarbonetos e como são classificados. Além disso, quais são suas características e propriedades físicas e químicas.

O que são hidrocarbonetos?
Os hidrocarbonetos são um grupo de compostos orgânicos . Suas moléculas são constituídas por átomos de carbono e hidrogênio, organizados em várias estruturas dependendo do tipo de hidrocarboneto.
Na maior parte, os hidrocarbonetos vêm do petróleo . Isso porque o óleo é o resultado da decomposição da matéria orgânica e, portanto, oferece grande quantidade e concentração de carbono e hidrogênio .
Os derivados de petróleo, ou seja, os hidrocarbonetos, estão envolvidos em vários setores , desde a aeronáutica até a indústria de brinquedos. Quase todos os combustíveis usados no transporte são derivados de hidrocarbonetos, uso pelo qual eles criam resíduos poluentes ( dióxido de carbono (CO 2 ) e monóxido de carbono (CO)). Por esse motivo, atualmente estão sendo feitas tentativas de substituí-los por outros tipos de combustíveis e fontes de energia .
Os hidrocarbonetos são um recurso não renovável , uma vez que não podem ser fabricados pelo homem .
Veja também: Polímeros
Estrutura orgânica molecular de hidrocarbonetos
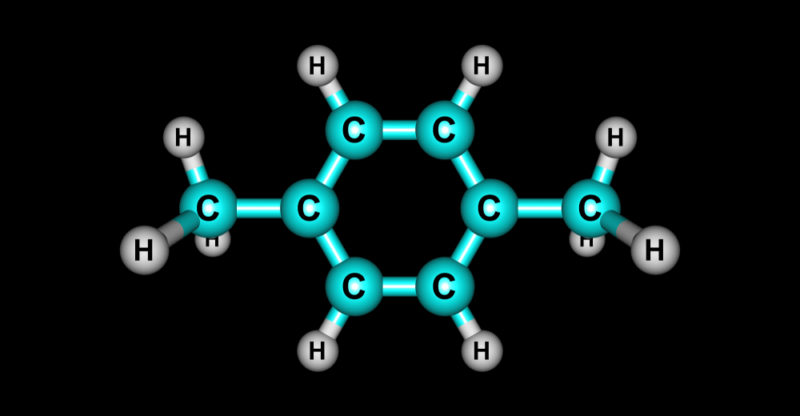
Todas as substâncias cujas moléculas contêm átomos de carbono em sua estrutura principal que formam ligações com outros átomos de carbono (ligação carbono – carbono) e com átomos de hidrogênio (ligação carbono – hidrogênio) são consideradas orgânicas . Porém, oxigênio , enxofre , fósforo e nitrogênio também podem fazer parte de sua estrutura . Os hidrocarbonetos são parte de moléculas orgânicas, que são compostas apenas de carbono e hidrogênio.
Embora cada hidrocarboneto tenha uma molécula distinta , todos eles compartilham uma cadeia de átomos de carbono em sua estrutura molecular , cada um dos quais também pode >
Tipos de hidrocarbonetos
Hidrocarbonetos aromáticos
Os hidrocarbonetos aromáticos possuem moléculas cíclicas, ou seja, os átomos de carbono formam um círculo . Entre os átomos de carbono existem ligações duplas alternadas com ligações simples. Um dos hidrocarbonetos aromáticos é o benzeno, assim como todos os seus derivados.
Hidrocarbonetos alifáticos
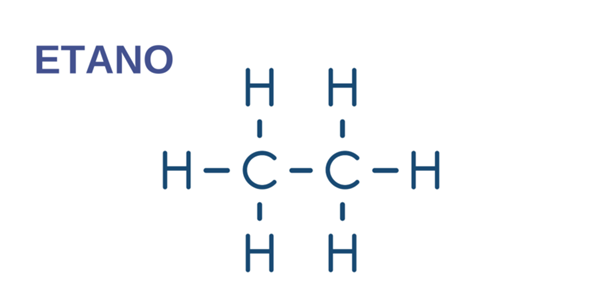
Os hidrocarbonetos alifáticos são aqueles que não formam anéis com ligações duplas alternadas com ligações simples, ou seja, não são aromáticos. As cadeias dos alifáticos podem ser abertas ou fechadas.
- Hidrocarbonetos alifáticos de cadeia aberta .
- Alcanos . As ligações entre todos os átomos de carbono são simples. A fórmula geral é C n H 2n + 2 (n é o número de carbonos).
- Alkenos . Pelo menos uma das ligações entre os átomos de carbono é dupla. A fórmula geral é C n H 2n .
- Alkynes . Pelo menos uma das ligações entre os átomos de carbono é tripla. A fórmula geral é C n H 2n-2 .
- Hidrocarbonetos alifáticos de cadeia fechada . Eles são chamados de cíclicos e as cadeias de átomos de carbono formam anéis, como no caso dos aromáticos. No entanto, os alifáticos não têm ligações alternativas com duplas simples. Muitos são chamados de cicloalcanos.
Saturação de hidrocarbonetos
Diz-se que uma substância está saturada quando em sua molécula todos os átomos de carbono estão unidos a outros átomos por ligações simples . A molécula é considerada saturada porque ligações simples não podem ser quebradas e, portanto, nenhum átomo de hidrogênio pode ser adicionado.
Os hidrocarbonetos saturados são alcanos e cicloalcanos . Os hidrocarbonetos insaturados são aromáticos, alcenos e alcinos.
Propriedades físicas dos hidrocarbonetos

- Seu ponto de ebulição aumenta à medida que aumenta o tamanho do hidrocarboneto (o número de átomos de carbono), embora a geometria molecular dessas moléculas também influencie. Isso ocorre porque as forças intermoleculares são maiores quando a molécula é maior. Por exemplo, o ponto de ebulição do butano (C 4 H 10 ) é 0 ° C, enquanto o ponto de ebulição do nonano (C 9 H 20 ) é 150,8 ° C.
- Sua densidade também aumenta quando a molécula é maior.
- Eles são insolúveis em água . Isso porque são substâncias apolares, ou seja, anulam-se as densidades de cargas elétricas nas diferentes regiões de cada molécula. Por outro lado, a água é uma molécula polar e, em química, a frase é freqüentemente usada: semelhante dissolve semelhante.
Propriedades químicas dos hidrocarbonetos
- Combustão . Os hidrocarbonetos podem ir para combustão completa ou incompleta (oxidação). Eles começam a se oxidar na presença de oxigênio ou de uma fonte de calor. Uma das substâncias resultantes da combustão completa é o dióxido de carbono (CO 2 ) e da combustão incompleta o monóxido de carbono (CO). É por isso que os hidrocarbonetos são substâncias poluentes quando usados como combustível.
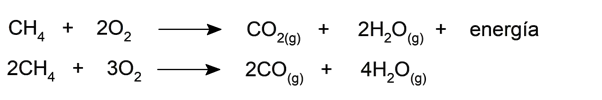
- Pirólise . É a decomposição de compostos orgânicos quando aquecidos a altas temperaturas sem a presença de oxigênio. Por exemplo, quando os alcanos são expostos a uma temperatura de 800 ° C, eles podem se decompor para formar alcenos, alcanos menores e hidrogênio livre.
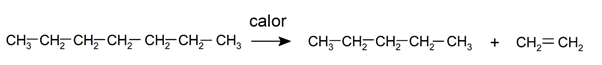
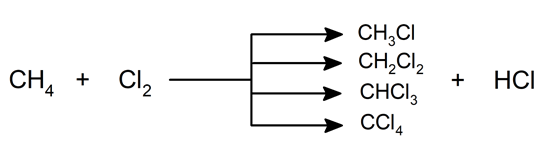
- Halogenação . Sob a presença de luz , especialmente raios ultravioleta, os alcanos reagem junto com os halogênios e produzem derivados halogenados.
Usos de hidrocarbonetos

Os hidrocarbonetos são usados principalmente como combustível para transporte e indústria , mas também em geradores elétricos. Além disso, são matéria-prima para lubrificantes e graxas para veículos, além do asfalto.
Os hidrocarbonetos são processados para fazer todos os tipos de plásticos , acrílicos, náilon, luvas, tintas , fibras sintéticas, recipientes, adesivos, inseticidas, detergentes, refrigerantes e fertilizantes.
Degradação de hidrocarbonetos

Os hidrocarbonetos são poluentes não apenas devido aos resíduos produzidos quando se inflamam, mas também quando o óleo (uma mistura de hidrocarbonetos) é derramado na terra ou na água. Apesar de serem substâncias orgânicas, os hidrocarbonetos geralmente não são biodegradáveis .
No entanto, pesquisas foram desenvolvidas para resolver esse problema . Para isso, é utilizada uma combinação de bactérias que degradam as moléculas de hidrocarbonetos em uma cadeia, ou seja, uma bactéria consegue quebrar a molécula para torná-la “comestível” para outra bactéria.
Nomenclatura de hidrocarbonetos
Para nomear hidrocarbonetos , uma série de prefixos (no início do nome) e sufixos (no final do nome) são usados para indicar o número de ligações e átomos.
Exemplos de prefixos de acordo com o número de átomos de carbono: Met (um átomo de carbono), Et (dois), Prop (três), But (quatro), Pent (cinco), Hex (seis), Hept (sete), Oct ( oito), Não (nove).
Sufixos de acordo com o tipo de hidrocarbonetos
- Alcanos : -ano. Por exemplo: butano (alcano com quatro átomos de carbono).
- Alcenos : -não. Por exemplo: penteno (alceno com cinco átomos de carbono).
- Alkynes : ino. Por exemplo: etino (alcino com dois átomos de carbono).
Se eles são cíclicos, o prefixo ciclo- seguido pelo nome do hidrocarboneto é colocado. Por exemplo: ciclobutano ou ciclopentano.
No caso de hidrocarbonetos que possuem ligações duplas ou triplas, um número que corresponde à posição do primeiro carbono que participa de tais ligações múltiplas deve ser inserido como um prefixo para o sufixo -eno (se for alceno) e para o sufixo -ino (se for alceno). alcino).
Exemplos de hidrocarbonetos
- Metano . CH 4 (alcano)
- Etano . CH 3 – CH 3 (alcano)
- Propano . CH 3 – CH 2 – CH 3 (alcano)
- Butano . CH 3 – CH 2 – CH 2 – CH 3 (alcano)
- But-1-ino ou 1-butino . CH ≡ C – CH 2 – CH 3 (alcino)
- Hep-3-ino ou 3-heptyne . CH 3 – CH 2 – C ≡ C – CH 2 – CH 3 (alcino)
Siga com: Carbon