Explicamos o que são as Leis da Termodinâmica e como são desenvolvidas. Além disso, quais são suas características e exemplos.
Quais são as leis da termodinâmica?
É conhecido como leis da termodinâmica ou princípios da termodinâmica a um conjunto de formulações que caracterizam os sistemas termodinâmicos com base em suas quantidades físicas fundamentais : temperatura , energia e entropia.
Os sistemas termodinâmicos são chamados de uma parte do universo que é teoricamente isolada para estudá-lo.
Existem quatro leis da termodinâmica , listadas de zero a três. Eles descrevem como esses sistemas operam em várias circunstâncias e contextos e proíbem a existência de alguns fenômenos, como o movimento perpétuo.
Estas são as formulações mais elementares deste ramo da física.
Veja também: Lei de Murphy
O que é termodinâmica?
A termodinâmica é um ramo da física dedicado à descrição dos estados de equilíbrio dos sistemas físicos no nível macroscópico, ou seja, aqueles cujas características são determináveis por elementos internos e não por forças externas que atuam sobre eles. Por isso, ele considera que a energia só pode ser trocada de um sistema para outro na forma de calor ou trabalho.
História da Termodinâmica
O primeiro princípio da termodinâmica a ser estabelecido foi obra de Nicolás Léonard Sadi Carnot em 1824 , que mais tarde foi chamada de Segunda Lei da Termodinâmica.
Em 1860, esse princípio foi expresso por Rudolf Clausius e William Thompson , com os quais mais tarde se tornou a Primeira Lei da Termodinâmica.
A terceira, mais moderna, foi proposta por Guggenheim e Fowler e foi chamada de “Lei Zero” em 1930, embora não seja reconhecida como tal em todas as áreas.
Lei zero da termodinâmica
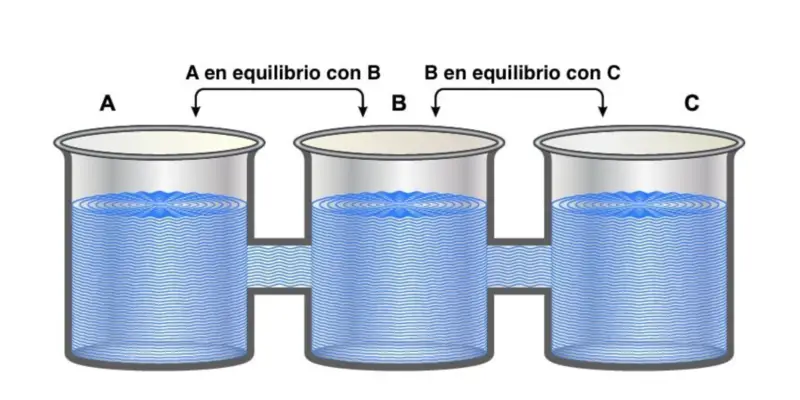
A “lei zero” é assim chamada porque, apesar de ter sido a última a concorrer , estabelece preceitos fundamentais para as outras três.
Ele indica que “se dois sistemas estão em equilíbrio térmico de forma independente com um terceiro sistema, eles também devem >
Isto pode ser expresso como logicamente que se A = B = C e C, então A = B .
Primeira Lei da Termodinâmica
Também conhecida como “Lei da Conservação de Energia” , afirma que em qualquer sistema físico isolado, a quantidade total de energia será a mesma ao longo do tempo , embora possa ser transformada em outras formas de energia.
Em outras palavras: “em um sistema isolado, a energia não pode ser criada ou destruída, apenas transformada” .
Outra forma de afirmar essa lei é por meio da relação entre o calor (Q) que um sistema termodinâmico recebe ou desiste, o trabalho feito ou recebido por ele e sua energia interna. Ao fornecer uma determinada quantidade de calor a um sistema, sua energia interna (ΔU) será igual à diferença entre essa quantidade de calor e o trabalho (W) que o sistema realiza em seu entorno.
Ou seja: Q = Δ U + W, ou o que é o mesmo: Δ U = Q – W .
Essa formulação afirma que a diferença entre a energia do sistema e o trabalho realizado será liberada do sistema na forma de calor.
Exemplo da primeira lei da termodinâmica

Vamos imaginar o motor de um carro . A gasolina é um sistema termodinâmico que reage com o oxigênio, gerando uma faísca que produz a combustão. Essa reação move um pistão que é responsável pelo movimento das rodas do carro (trabalho). Além disso, todo o processo gera calor que sai pelo escapamento.
Se pudéssemos medir a quantidade de combustível consumido, a quantidade de trabalho realizado e a quantidade de calor liberado, concluiríamos que a energia do motor permaneceu constante ao longo do tempo (nenhuma energia foi criada ou destruída).
Segunda lei da termodinâmica
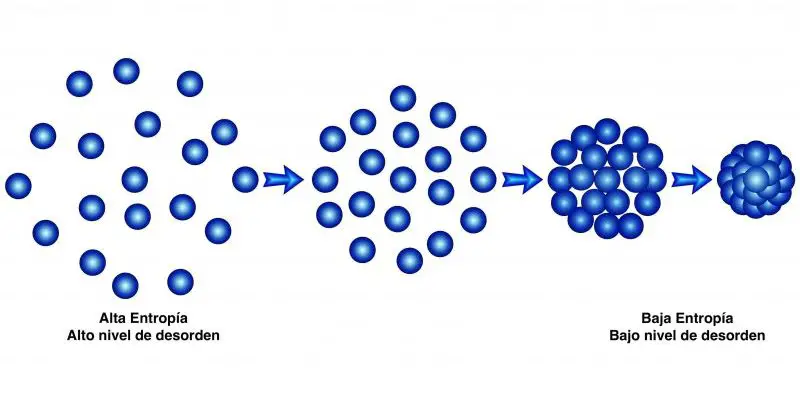
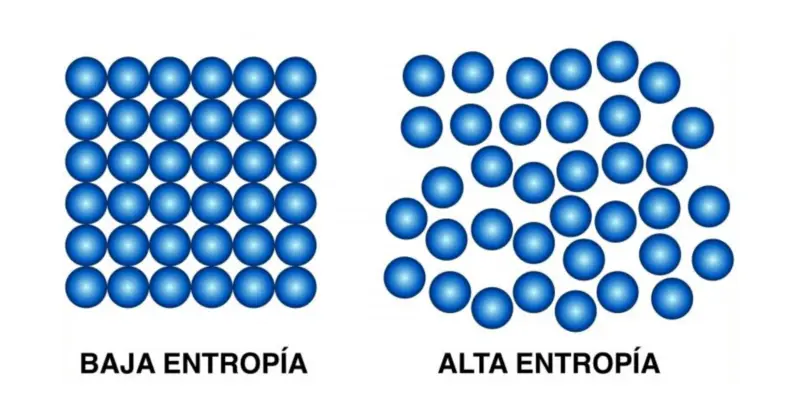
Este segundo princípio afirma que “a quantidade de entropia no universo tende a aumentar com o tempo” , ou seja, a desordem de todos os sistemas aumenta até que atinjam o equilíbrio.
Em outras palavras: com tempo suficiente, todos os sistemas tendem ao equilíbrio, que é o estado de desordem máxima, entropia máxima.
Esta lei postula a irreversibilidade dos fenômenos físicos e introduz a função de estado de entropia (S).
Assim como a primeira lei relaciona as diferentes energias envolvidas em um processo, a segunda lei impõe restrições à sua direção e um limite superior à eficiência de uma máquina térmica. Isso significa que nenhuma máquina que converte calor em trabalho pode fazê-lo com 100% de eficiência. Assim, a segunda lei é extremamente importante para muitas aplicações na vida cotidiana e para a indústria .
Este princípio também é formulado classicamente como a mudança na entropia (dS) será sempre igual ou maior que a transferência de calor (Q), dividida pela temperatura (T) da fonte que fornece ou absorve aquele calor: dS ≥ δQ / T
Exemplo da segunda lei da termodinâmica
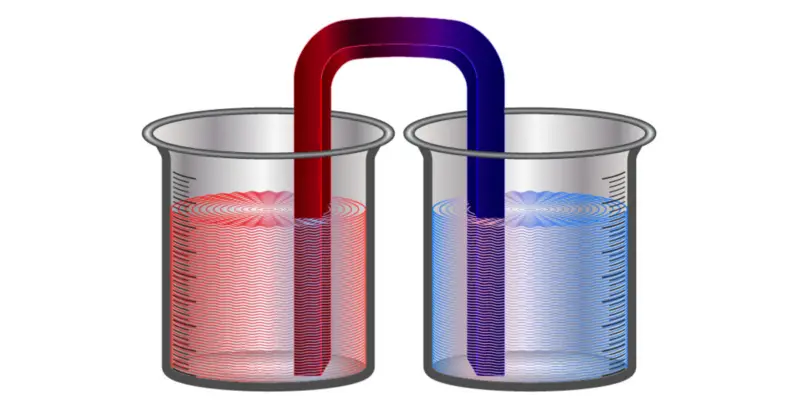
Uma vez que esta lei determina a irreversibilidade dos fenômenos físicos , é facilmente possível verificá-la. Se colocarmos em contato dois corpos com temperaturas diferentes, depois de um certo tempo a entropia aumentará e suas temperaturas serão as mesmas. Se separarmos os corpos, ambos manterão essas temperaturas de equilíbrio e não retornarão naturalmente às originais. O processo é irreversível.
Terceira lei da termodinâmica
Também conhecido como Postulado de Nerst , esta lei afirma que a entropia de um sistema levado ao zero absoluto é uma constante definida:
- Ao atingir o zero absoluto (0 K), os processos dos sistemas físicos param.
- Ao atingir o zero absoluto (0 K), a entropia terá um valor mínimo constante.
Exemplo da terceira lei da termodinâmica

Embora seja difícil atingir diariamente temperaturas próximas do chamado zero absoluto (-273,15 ° C, valor que ainda não foi alcançado), esse princípio pode ser exemplificado pelo que acontece em nosso freezer : as carnes e os alimentos que ali depositamos serão levados a baixíssimas temperaturas, para desacelerar ou até mesmo interromper praticamente os processos bioquímicos internos, retardando sua decomposição e maximizando sua vida útil.
Por que as leis da termodinâmica são importantes?
Esses quatro preceitos termodinâmicos descrevem o modo de operação dos sistemas termodinâmicos e, portanto, oferecem um guia aplicável ao entendimento, pelo menos teórico, da física universal.
São o resultado da capacidade analítica do ser humano (não tanto de experimentação, são princípios teóricos) e ao mesmo tempo são o suporte de futuras análises e considerações sobre o assunto .