Explicamos o que é o modelo atômico de Bohr, sua origem e suas principais características. Além disso, as principais contribuições deste modelo.

O que é o modelo atômico de Bohr?
Niels Bohr foi um físico dinamarquês que em 1913 propôs um novo modelo para explicar a estrutura do átomo e seu comportamento por meio da estabilidade dos elétrons . Por essa contribuição decisiva para o conhecimento, ele recebeu o Prêmio Nobel de Física em 1922.
O modelo proposto por Bohr trabalhou para entender o funcionamento de certos tipos de átomos , como o hidrogênio , mas não para outros de estrutura mais complexa. No entanto, seu modelo abriu as portas para estabelecer as seguintes teorias e foi a base do modelo atômico moderno ou atual.
Isso pode ajudá-lo: Dalton Atomic Model
Origem do modelo atômico de Bohr
Durante o tempo da Grécia antiga, pensava-se que a matéria era composta de princípios ou elementos indivisíveis, ou seja, eles não podiam ser divididos em partes ainda menores (como a água ou o ar ).
No entanto, o trabalho do químico John Dalton no final da Idade Moderna forneceu as primeiras abordagens científicas que estabeleceram as bases para a estequiometria química. Em 1803, ele apresentou sua teoria atômica de que a matéria era composta de átomos de diferentes estruturas.
Em 1897, Joseph Thomson descobriu o elétron como parte do átomo e em 1911 Ernest Rutherford desenvolveu uma teoria sobre a estrutura interna do átomo . Niels Bohr foi quem entendeu e descreveu a organização dessas partículas chamadas elétrons e sua distribuição em órbitas específicas ao redor do núcleo do átomo.
Características do modelo atômico de Bohr
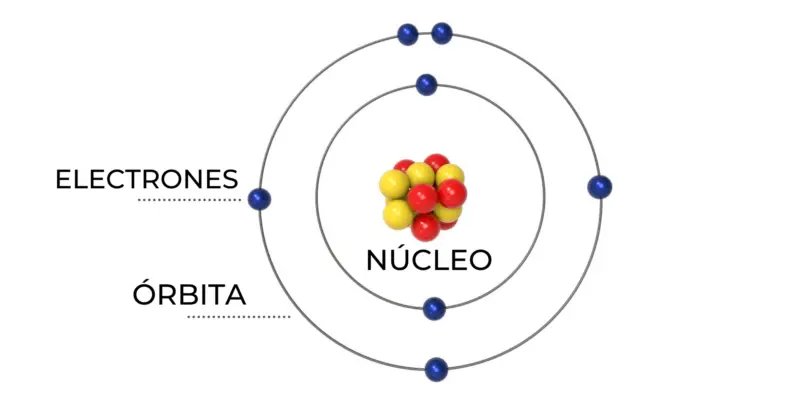
O modelo atômico de Bohr, que era a base do modelo atômico atual, explicava a estabilidade da matéria e a conformação das ligações químicas . Observar a representação gráfica do modelo de Bohr tornará mais fácil entender as seguintes características:
- Os elétrons que circundam o núcleo de um átomo podem ser internos ou externos. Ambos os tipos de elétrons estão em órbitas circulares ao redor do núcleo, mas os elétrons não podem >
- Os elétrons estão em níveis de energia definidos e a distâncias fixas. A órbita mais próxima do núcleo tem menos energia do que a órbita mais distante do núcleo, que tem mais energia.
- As órbitas possuem um certo número de elétrons, dependendo de sua distância do núcleo. Essa escala de distribuição é chamada de “configurações eletrônicas” e é equivalente à escala da tabela periódica (representada na ordem das linhas).
- Os elétrons podem saltar de nível ou órbita, e esse salto só pode ocorrer de e para as órbitas permitidas. Por exemplo, um elétron que salta de uma órbita externa para uma interna perde energia, que é liberada como um fóton ou luz . Se ele pula de uma órbita interna para uma externa, ele ganha energia.
- A quantidade mínima de energia que pode ser ganha ou perdida em qualquer comprimento de onda é chamada de “quantum de energia”, daí a expressão “salto quântico” para se referir a uma mudança nos elétrons de um nível de energia para outro. Essa mudança está associada a uma perda ou ganho de energia.
Principais contribuições de Bohr
O modelo de Bohr foi o primeiro a reconhecer o conceito de mecânica quântica na estrutura eletrônica de um átomo de hidrogênio e, além disso, revelou como era a estabilidade dos átomos .
A teoria clássica sustentava que um elétron (com carga negativa) que orbitava em torno de um núcleo (com carga positiva) emitia energia eletromagnética e perdia velocidade até cair no núcleo.
Mas os testes experimentais não mostraram o processo proposto pela teoria clássica. Usando o modelo de Bohr e o trabalho de vários outros físicos, eles conseguiram resolvê-lo.
Em 1916, o físico alemão Arnold Sommerfel otimizou o modelo atômico de Bohr de que os elétrons giram em órbitas circulares para acrescentar que, além disso, eles poderiam girar em órbitas elípticas mais complexas.
Ao conceito de mecânica quântica proposto por Bohr, foi adicionado o modelo quântico não relativístico do físico austríaco Erwin Schrödinger , em 1926, cuja teoria considerava os elétrons como ondas estacionárias de matéria que provavelmente >
Em 1927, os físicos alemães Max Born e Werner Heisenberg contribuíram com o princípio da incerteza para o conceito de probabilidade de Schrödinger , que estabelecia que a posição e a velocidade do elétron não podiam ser conhecidas simultaneamente. Portanto, sua trajetória exata não poderia ser conhecida.
Por meio dessas contribuições gerais e de vários estudos e teorias de outros físicos e matemáticos, foi possível resolver o dilema colocado pela teoria clássica que era inverificável a partir dos testes experimentais.
Pode te ajudar: Campo magnético