Explicamos o que são os sais, as propriedades que apresentam e como são classificados. Além disso, quais são suas características e alguns exemplos.

O que são sais?
Sais são compostos químicos resultantes de uma ligação iônica entre partículas químicas carregadas positivamente (cátions) e outras com carga negativa (ânions). Eles são o resultado típico da reação química entre um ácido e uma base , também conhecida como neutralização.
Existem diferentes tipos de sais, diferenciados na sua composição química e na sua utilidade para as indústrias humanas, bem como na sua nomenclatura. Talvez o mais conhecido de todos seja o cloreto de sódio (NaCl), que é o sal comum ou de mesa, usado na cozinha.
Veja também: Halogênios
Propriedades dos sais

As propriedades dos sais podem ser muito variadas , dependendo de sua composição.
Em geral, são compostos cristalinos , com estrutura iônica.
Sua estrutura confere-lhes altos pontos de fusão e propriedades dielétricas no estado sólido .
No entanto, eles são solúveis em água .
Costumam ter cores diferentes (desde o branco do sal comum ao vermelho, preto, azul e lilás, dependendo dos seus componentes). Seus sabores variam entre salgado, doce, azedo e amargo. Eles exalam pouco ou nenhum odor.
Classificação de sais por composição
As classes podem ser classificadas de acordo com a proporção de íons que as compõem, ou de ácidos e bases:
- Sais básicos ou hidroxisais. Composto por dois ânions e um cátion.
- Sais ácidos ou de sódio. Eles são compostos de dois cátions e um ânion.
- Sais neutros. Produto da neutralização total de um ácido e uma base, eles carecem dos íons H + e OH- devido ao seu caráter neutro.
- Sais mistos. Composto por dois cátions ou dois ânions diferentes, que têm íons diferentes de H + e OH-.
- Sais hidratados. Sais em cuja composição cristalina aparecem moléculas de água.
Classificação de sais por elementos

Outra forma de classificar os sais é baseada no número de elementos presentes em sua fórmula, conforme segue:
- Sais binários. Eles têm dois elementos: um metal e um não metálico . Exemplo: NaCl.
- Sais ternários. Eles têm três elementos: um metal, um não metal e um oxigênio . Exemplo: PbSeO 3 .
- Sais quaternários. Eles apresentam quatro elementos diferentes, entre metais e não metais. Exemplo: NaHCO 3 .
Como os sais são formados?
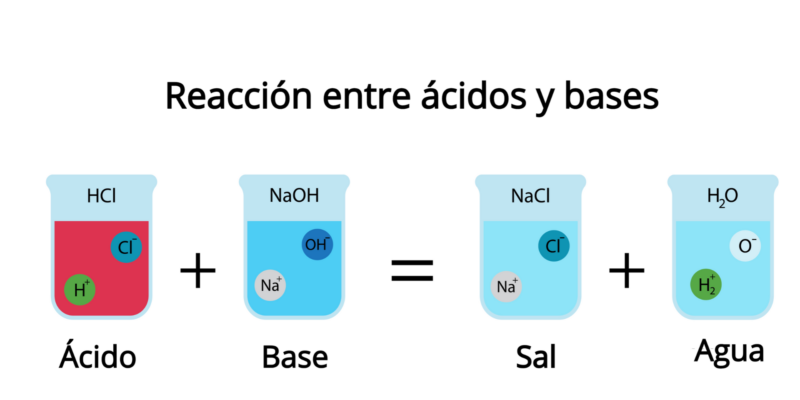
Sais formados quando, em um ácido, os átomos de hidrogênio são substituídos por átomos de metal ou outros reagentes iônicos de uma base ou álcali. Isso geralmente ocorre no processo conhecido como neutralização.
Sua fórmula que é:
ácido + base = sal + água
Lá, a base fornece um cátion e o ácido, o ânion, para formar o sal. Por exemplo:
HCl + NaOH = NaCl + H 2 O
Outro caso de formação de sal, embora menos frequente, é o resultado das seguintes reações:
- Ácido + Metal. Como em H 2 SO 4 + Zn = ZnSO 4 + H 2
- Base + Base. Como em Na 2 SO 4 + BaCl 2 = BaSO 4 + 2 NaCl
- Ácido + óxido. Como em 2HBr + 2NaO = 2NaBr + H 2 S
Nomenclatura de sais
Os sais são nomeados da seguinte forma:
- Sais hidrácidos (ácidos que não contêm oxigênio em sua molécula). A terminação – hídrico é substituída pela terminação – uro . Por exemplo, se o sal vem do ácido clorídrico , o cloro pode ser chamado de uro .
- Sais oxidados. A desinência – bear ou – ico é substituída pela desinência – ito ou – ato . Por exemplo, se o sal for derivado do ácido fosfórico, o fosfórico será denominado ato .
- Sais de ácido (com átomos de hidrogênio substituíveis). Eles são chamados de indicando o número de hidrogênios não substituídos na molécula, usando o prefixo correspondente. Por exemplo, o sal NaHS é chamado de sulfeto de hidrogênio de sódio, uma vez que o ânion HS vem do sulfeto de hidrogênio.
- Sais básicos (com hidroxila ou moléculas OH). Eles são nomeados indicando o número de hidroxila seguido pelo ânion central e finalmente o cátion. Por exemplo, MgCl (OH) é chamado de hidroxicloreto de magnésio.
- Sais hidratados. Eles são nomeados indicando o sal correspondente e, em seguida, o número de moléculas de hidratação. Por exemplo: MgSO 4 x 5H 2 O é chamado de sulfato de magnésio pentahidratado.
Onde os sais são encontrados?

Os sais podem ser encontrados como parte de minerais subterrâneos e rochosos , como a halita, ou também dissolvidos na água, como nos oceanos e mares . Eles são compostos abundantes e necessários para a vida orgânica como a conhecemos, portanto, não são difíceis de adquirir através dos alimentos .
Importância biológica dos sais
Os sais são parte de muitos compostos orgânicos . Além disso, eles ocupam um lugar central nos processos biológicos, como:
- Contração muscular
- Transmissão de impulsos nervosos
- Síntese de clorofila
- Transporte de oxigênio na hemoglobina
- Funcionamento de enzimas
- Geração de estruturas sólidas insolúveis, como ossos, conchas, etc.
Para que são usados os sais?

Os sais têm usos diferentes nas indústrias humanas. Na gastronomia são utilizados como ingredientes como o sal comum ou o bicarbonato de sódio. Na indústria farmacêutica, são usados como laxantes e base de suprimentos médicos.
Mas seu uso industrial é generalizado. Por exemplo, são a base da extinção de incêndios e de diversos materiais de construção . Eles também podem ser dessecantes e fertilizantes. Alguns sais mais específicos são usados para fazer explosivos ou para a indústria fotográfica.
Sais minerais

São compostos iônicos, de origem totalmente inorgânica (daí o nome “mineral”). Porém, também podem ser encontrados no corpo dos seres vivos , que devem consumi-los por meio da alimentação , pois com eles são desempenhadas várias funções de regulação, metabolismo e excitabilidade nervosa.
São particularmente abundantes em nosso planeta , formando parte dos minerais do subsolo ou dissolvidos nas águas marinhas. Em princípio, eles não se distinguem dos sais orgânicos, exceto pelo tipo de elementos presentes em sua constituição molecular.
Exemplos de sais
Alguns sais comumente usados são os seguintes:
- Nitrato de sódio (NaNO 3 ). Usado para o tratamento do botulismo (doença causada por neurotoxinas de origem bacteriana).
- Nitrito de sódio (NaNO 2 ). Utilizado na indústria alimentícia como conservante e também como fixador de cor.
- Bicarbonato de lítio (LiHCO 3 ). Usado como agente de captura de CO 2 em missões espaciais.
- Hidrogenossulfeto de sódio (NaHS). Sal perigoso e de manuseio delicado, altamente corrosivo, combustível e tóxico.
- Fosfato dicálcico (CaHPO 4 ). Conhecidos como mono-hidrogenofosfato de cálcio, são usados como aditivos em alimentos e pastas de dente.