Explicamos o que são os metalóides e como são suas formas e coloração. Além disso, quais são suas características, propriedades e usos.
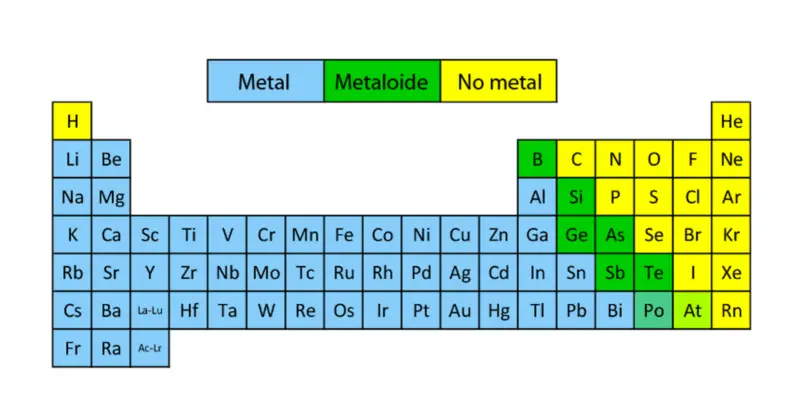
O que são metalóides?
Metalóides ou semimetais são um tipo de elementos químicos que apresentam um comportamento intermediário entre metais e não metais , em termos de energias de ionização e propriedades de ligação.
Não é fácil distingui-los dos metais verdadeiros. Eles conduzem a corrente elétrica melhor do que os não-metais, mas não são bons condutores como os metais. Além disso, geralmente são muito variados em sua forma e coloração .
A lista de metaloides inclui os seguintes itens:
- Boro (B)
- Silício (Si)
- Germânio (Ge)
- Arsênico (As)
- Antimônio (Sb)
- Telúrio (Te)
- Polônio (Po)
Veja também: Metais alcalinos
Características de metaloides

- Localização na Tabela Periódica . Os metalóides são encontrados, dentro da Tabela Periódica, em uma diagonal descendente do boro ao polônio, espalhados entre as colunas 13, 14, 15 e 16, e dividindo a tabela em duas. Os elementos que estão localizados no meio da direita não são metálicos e os que estão localizados à esquerda são metálicos.
- Forma e coloração . Os metalóides são muito variados em sua forma e cor. Podem ser brilhantes ou opacos, e muitos deles apresentam mais de um estado alotrópico, ou seja, apresentações diferentes de acordo com sua estrutura molecular. O arsênico, por exemplo, pode ser cinza, amarelo ou preto, dependendo de sua forma alotrópica. O silício, da mesma forma, pode aparecer como um cristal sólido brilhante ou como um pó amorfo acastanhado.
- Condução elétrica . A maioria dos metalóides são semicondutores (eles podem se comportar como condutores ou isolantes e transmitir eletricidade melhor de uma forma do que de outra) em vez de condutores completos, e por serem distintos dos elementos metálicos. No entanto, eles são condutores muito melhores do que elementos não metálicos (isoladores), razão pela qual são freqüentemente usados na indústria de fabricação de eletrônicos.
- Condução térmica . Os metalóides conduzem a energia térmica muito melhor do que os elementos não metálicos, sem atingir a alta condutividade dos metálicos. Em geral, eles não são considerados bons condutores de calor.
- Reatividade . Dada a sua condição intermediária, os metalóides reagem de forma diferente dependendo se estão na presença de um elemento metálico (então eles reagem como um não-metal) ou um elemento não-metálico (então eles reagem como um metal). Eles têm afinidade por vários elementos, dependendo de cada um, por isso são normalmente encontrados em minerais junto com eles, como urânio, chumbo , enxofre , etc.
- Toxicidade . Embora alguns metalóides sejam essenciais para a formação de moléculas vitais (por exemplo, o arsênico, que é encontrado no corpo dos seres vivos ), eles podem representar um perigo para a saúde. O envenenamento por boro ou arsênico (altamente tóxico) pode ser fatal; e, por sua vez, o polônio é um elemento tóxico e altamente radioativo, ou seja, emite partículas alfa prejudiciais à saúde, por serem potencialmente carcinogênicas, imunossupressoras e mutagênicas.
Estados de agregação de metalóides

A maioria dos metalóides são geralmente sólidos à temperatura ambiente , como cristais (como o arsênio) ou blocos opacos e quebradiços (como o germânio).
No entanto, alguns têm propriedades curiosas em termos de mudança de fase. Por exemplo, o arsênio vai diretamente de um sólido para um gás (sublimação) na presença de calor (e em pressões atmosféricas normais).
Propriedades Atômicas de Metalóides

Os metalóides são muito diversos em sua caracterização atômica. Existem alguns com grande peso atômico, como o polônio (209 u) ou antimônio (121,76 u), e outros bastante leves, como o boro (10,81 u) e o silício (28,08 u).
O mesmo ocorre com suas densidades, que variam de 2,37 g / cm 3 (boro) a 9,32 g / cm 3 (polônio) e com sua configuração eletrônica, que pode ter diferentes quantidades de elétrons na última camada.: 3 (boro) , 4 (silício, germânio), 5 (arsênio, antimônio) e 6 (telúrio, polônio).
Abundância de metaloides
Alguns metalóides são extremamente abundantes na crosta terrestre , como o silício, que forma vários compostos chamados silicatos ou arsênico.
O boro, por sua vez, existe em abundância, mas como parte do mineral chamado bórax, uma vez que não existe na natureza em estado livre e puro.
O polônio, por outro lado, é bastante raro e aparece apenas como parte de certos minerais de urânio; e o antimônio é encontrado em porcentagens muito pequenas na crosta terrestre.
Usos de metalóides

A maioria dos semimetais é usada para fabricar dispositivos eletrônicos e elementos semicondutores, como retificadores, transistores, diodos, circuitos integrados ou mesmo (como no caso do silício), chips e microprocessadores . No entanto, sua variedade permite muitos usos diferentes.
Por exemplo, alguns isótopos de boro são úteis na absorção de nêutrons em usinas nucleares e funcionam como mecanismos de regulação de reações atômicas.
Continue com: Gases nobres