Explicamos o que são ácidos e bases e como essas substâncias podem ser medidas. Além disso, quais são suas características e vários usos.
O que são ácidos e bases?
Ácidos e bases são substâncias existentes na natureza e que se distinguem pelo nível de pH , ou seja, pelo grau de acidez ou alcalinidade. Ambos, no entanto, tendem a ser corrosivos, muitas vezes substâncias tóxicas, que, no entanto, têm inúmeras aplicações industriais e humanas.
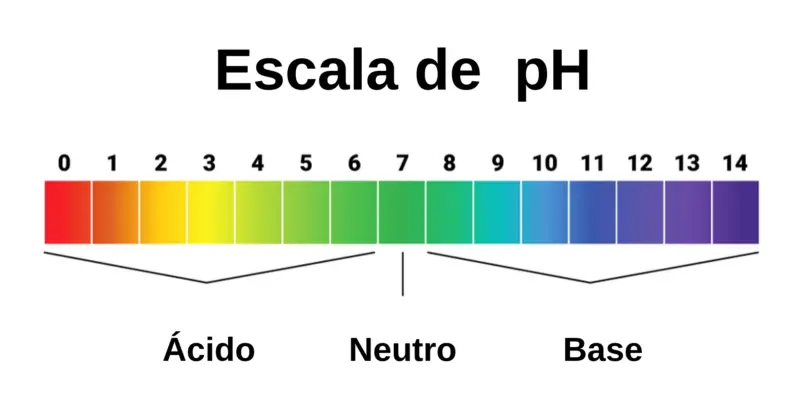
Ácidos são substâncias com pH inferior a 7 (pH da água igual a 7, considerado neutro), cuja química comumente contém grandes quantidades de íons hidrogênio quando a água é adicionada . Eles tendem a reagir a outras substâncias perdendo prótons (H + ).
As bases, por outro lado, são substâncias com pH superior a 7 , que em soluções aquosas geralmente contribuem com íons hidroxila (OH – ) para o meio. Eles geralmente são oxidantes poderosos, ou seja, eles reagem com prótons no ambiente circundante.
A reação entre ácidos e bases é chamada de neutralização, e mais ou menos remove as propriedades ácidas ou básicas de ambos os compostos, produzindo água e um sal .
Veja também: Compostos orgânicos
Características de ácidos e bases

- Sabor . As bases e os ácidos são facilmente distinguidos pelo seu sabor. Os primeiros têm um sabor amargo característico, enquanto os ácidos geralmente são azedos, como o ácido cítrico do limão. Algumas bases menos intensas tendem a ter sabores semelhantes ao sabonete.
- Condutividade elétrica . Tanto os ácidos quanto as bases, em soluções aquosas, são condutores elétricos muito bons. Isso se deve à sua capacidade de gerar íons carregados eletricamente.
- Solubilidade . De um modo geral, os ácidos e as bases são solúveis em água. No entanto, muitas bases fortes, como a soda cáustica (NaOH), liberam uma enorme quantidade de energia ao fazê-lo (reação exotérmica), portanto, seu contato com esse líquido é considerado um grave risco de inflamação.
- Reatividade . Ácidos e bases diferem porque os ácidos liberam prótons, enquanto as bases aceitam prótons das substâncias que os acompanham. Isso significa que eles tendem a reagir quimicamente de maneiras diferentes a substâncias como a matéria orgânica, embora em ambos os casos o efeito visível seja a corrosão: tanto os ácidos quanto as bases podem causar queimaduras graves na pele , por exemplo.
- Aparência . Os ácidos têm consistência oleosa, enquanto algumas bases podem ter um toque ensaboado. No entanto, no estado sólido tendem a ser mais ou menos porosos e quebradiços, dependendo da substância específica. Alguns gases ácidos ou básicos são visíveis a olho nu.

Neutralização
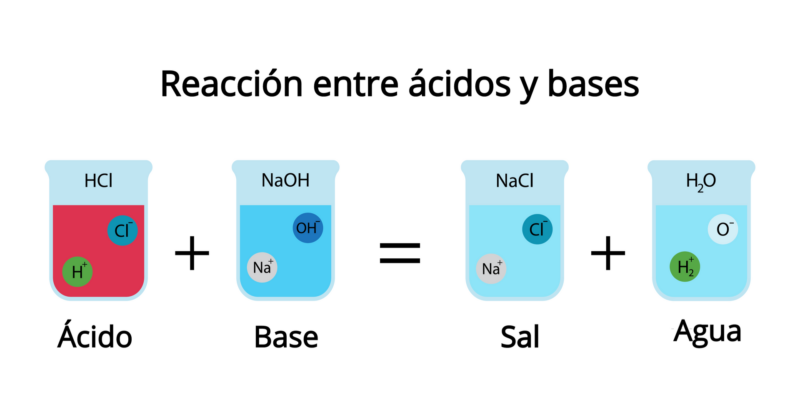
Ao misturar uma base com um ácido, ocorre um efeito de neutralização , no qual os prótons liberados pelo ácido são aceitos pela base e ambos perdem algumas (ou todas) suas propriedades ácidas ou básicas.
Como produto dessa reação, forma-se água e algum tipo de sal, dependendo do ácido e da base envolvidos. Portanto, a substância resultante não é ácida nem alcalina, mas salgada. Por exemplo: ácido clorídrico (HCl (aq) ) reage com hidróxido de sódio (NaOH) para formar o sal de cloreto de sódio (NaCl) e de ua (H 2 O).
Estados físicos

Tanto os ácidos quanto os álcalis podem ser encontrados em qualquer um dos três estados de agregação da matéria: sólido (pó), gasoso ou líquido .
As formas gasosas são as de maior risco industrial e humano, pois muitas vezes não são percebidas antes de serem inaladas e causam danos ao aparelho respiratório .
Medição de pH

Para medir o pH (acidez ou alcalinidade de uma substância em solução aquosa) de substâncias , são utilizados indicadores ácido-base , que são substâncias, materiais ou instrumentos de medição que servem para medir a acidez ou alcalinidade de um composto químico.
Existe um tipo especial de papel chamado papel de tornassol azul , que muda sua cor para vermelho se entrar em contato com um ácido e nada acontecer com a base.
Existem também substâncias líquidas, como a fenolftaleína, que ficam rosadas se em contato com uma base e incolores se em contato com um ácido. Por outro lado, o laranja de metila é um indicador de pH que apresenta uma cor vermelha em pH menor que 3 e amarela em pH maior que 4.
Aplicações de ácidos e bases

Tanto as bases quanto os ácidos têm inúmeras aplicações industriais:
- Ácidos . Suas propriedades corrosivas são usadas para remover ferrugem e outras impurezas de substâncias industriais (como metais ). Além disso, são utilizados em reações químicas que permitem a obtenção de eletricidade (como no caso das baterias). Além disso, fazem parte dos fertilizantes e costumam ser usados como catalisadores em reações químicas controladas, para obtenção de produtos específicos em laboratório.
- Bases . Muitas vezes são usados como dessecantes ou produtos para combater a umidade, além de substâncias de limpeza e desinfecção, como sabonete, cloro em piscinas e até amônia. Eles também são produzidos como medicamentos contra os ácidos, como o bicarbonato de sódio, ou como purgantes, como o leite de magnésia.
Nomenclatura

O nome dos ácidos vem do latim acidus , que significa ” azedo “ ; as bases, por outro lado, chamadas de álcalis, recebem seu nome do árabe Al-Qaly , que significa “cinza”. Nesses nomes pode-se perceber como o homem os trata desde a antiguidade, procurando distinguir uns dos outros a partir de suas características.
Nomenclatura de ácidos.
Oxácidos . Eles são ácidos que contêm oxigênio, um não metal e hidrogênio. Para nomeá-los, são usados prefixos e sufixos que dependem da quantidade de números de oxidação que o não metal possui. Por exemplo:
- Se o não metal tiver quatro números de oxidação:
- Para o menor número de oxidação . A palavra ‘ácido’ é escrita seguida pelo prefixo ‘hipo-‘ da palavra que se refere ao não metal, seguida pelo sufixo ‘-oso’. Por exemplo: ácido hipocloroso (HClO), o cloro tem número de oxidação 1+.
- Para o seguinte número de oxidação . A palavra ‘ácido’ é escrita seguida pela palavra que se refere ao não metal, seguida pelo sufixo ‘-oso’. Por exemplo: ácido cloroso (HClO 2 ), o cloro tem número de oxidação 3+.
- Para o número de oxidação a seguir . A palavra ‘ácido’ é escrita seguida pela palavra que se refere ao não metal, seguida pelo sufixo ‘-ico’. Por exemplo: ácido clorídrico (HClO 3 ), o cloro possui número de oxidação 5+.
- Para o maior número de oxidação . A palavra ‘ácido’ é escrita seguida pelo prefixo ‘per-‘ da palavra que se refere ao não metal, seguida pelo sufixo ‘-ico’. Por exemplo: ácido perclórico (HClO 4 ), o cloro possui número de oxidação 7 +.
- Se o não metal tiver dois estados de oxidação:
- Para o menor número de oxidação . A palavra ‘ácido’ é escrita seguida pela palavra que se refere ao não metal, seguida pelo sufixo ‘-oso’. Por exemplo: ácido sulfuroso (H 2 SO 3 ), o enxofre tem número de oxidação 4+.
- Para o maior número de oxidação . A palavra ‘ácido’ é escrita seguida pela palavra que se refere ao não metal, seguida pelo sufixo ‘-ico’. Por exemplo: ácido sulfúrico (H 2 SO 4 ), o enxofre tem número de oxidação 6+.
Ácidos binários ou hidrácidos . São ácidos compostos por hidrogênio e um halogênio (F, Cl, Br, I) ou um elemento do grupo VI A da Tabela Periódica diferente do oxigênio (S, Se, Te). Eles são nomeados colocando a palavra ‘ácido’ seguida pela palavra que se refere ao nome do não-metal, seguida pelo sufixo ‘-hídrico’. Você deve colocar o subscrito (ac) em sua fórmula, o que significa que eles estão em solução aquosa. Por exemplo: ácido clorídrico (HCl (aq) ), ácido bromídrico (HBr (aq) ) e sulfeto de hidrogênio (H 2 S (aq) ).
Nomenclatura das bases
A maioria das bases costumam ser denominadas hidróxidos , em alusão ao grupo funcional hidroxila (OH- ) que esses compostos apresentam. Eles são nomeados escrevendo a frase ‘hidróxido de’ seguido do nome do metal, seguido pelo número de oxidação do metal em algarismos romanos e entre parênteses (no caso de ter mais de um número de oxidação). Por exemplo: hidróxido de sódio (NaOH), hidróxido de magnésio (Mg (OH) 2 ), hidróxido de ferro (II) (Fe (OH) 2 ) e hidróxido de ferro (III) (Fe (OH) 3 ).
Continue com: Química Orgânica