Explicamos o que é a água e como é sua estrutura. Além disso, quais são os seus diversos usos e as principais características desta substância.

O que é agua
A água é uma substância fundamental para a vida e o solvente universal . Nossos tecidos e os de quase todos os seres vivos o têm como componente majoritário.
Estima-se que existam aproximadamente 1.386 milhões de km 3 de água na Terra , mas apenas 2,5% desse total (cerca de 35 milhões de km 3 ) corresponde a água que pode ser tornada segura e consumida sem grandes riscos.
Desta pequena parte, cerca de dois terços encontram-se nas grandes massas de gelo das calotas polares , pelo que as reservas de água doce disponíveis para satisfazer as necessidades da população são hoje muito escassas e limitadas às águas doces superficiais. ( Rios e lagos ) e a aqüíferos subterrâneos.
Veja também: Água potável
Estrutura da água

A molécula de água constitui um dipolo (sistema formado por duas cargas de sinal oposto, mas magnitude igual) . A molécula de água é composta por dois átomos de hidrogênio e um átomo de oxigênio e assume caráter polar. Isso significa que ele tem uma região com uma densidade de carga ligeiramente negativa (a do oxigênio ) e outra área que assume um diferencial de carga positiva (a dos hidrogênios ). As propriedades bioquímicas mais marcantes desta molécula estão ligadas, precisamente, a esta propriedade.
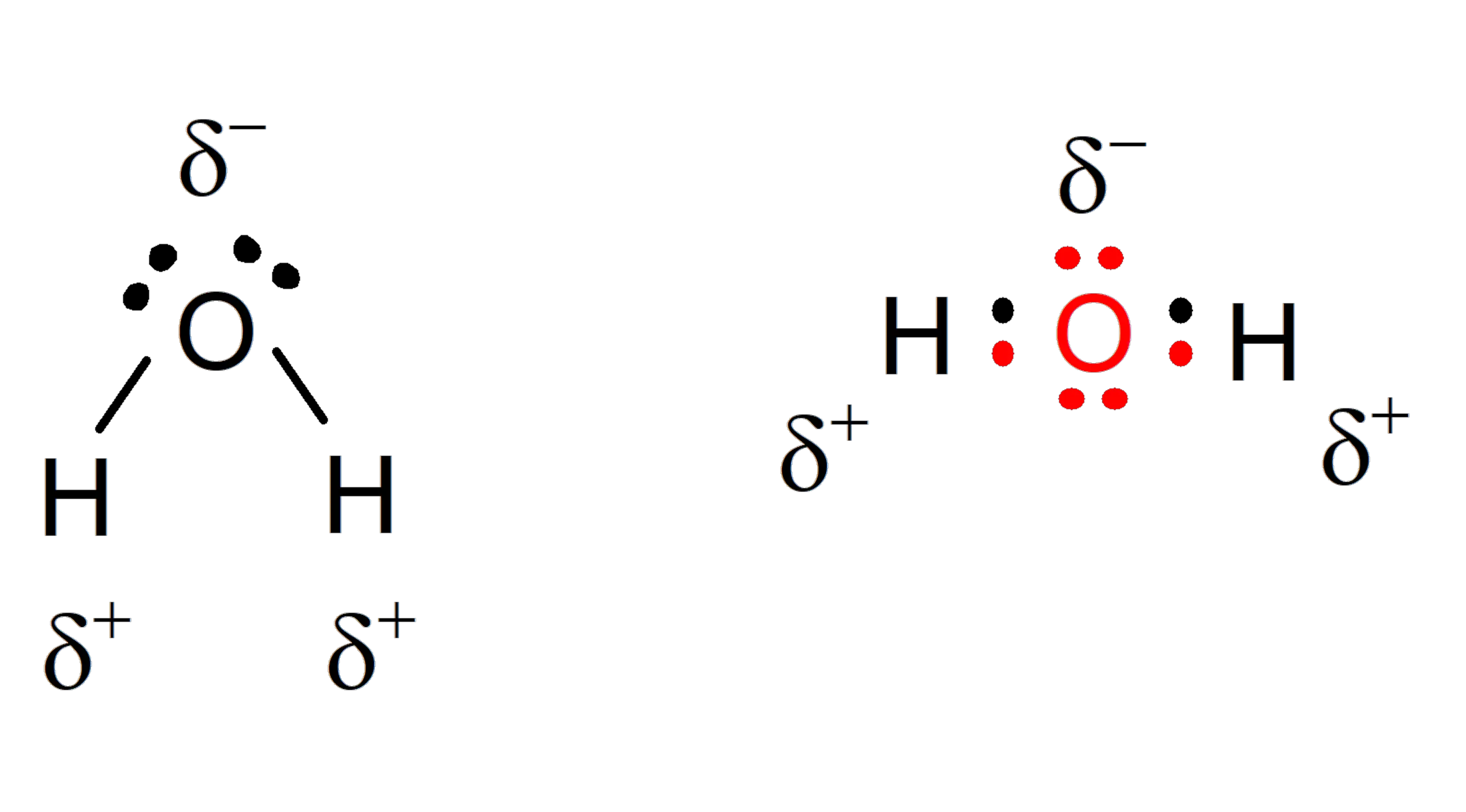
Características químicas da água
- Possui alta resistência de coesão . A água se caracteriza pela alta força de coesão entre suas moléculas, devido à formação de pontes de hidrogênio. A presença de cargas parciais positivas e negativas na mesma molécula faz com que se comportem como ímãs (as partes com carga parcial positiva atraem as partes com carga parcial negativa). Dessa forma, uma molécula de água pode se juntar a outras 4 moléculas de água por meio do que é conhecido como “ligações de hidrogênio”, que não são ligações químicas, mas interações eletrostáticas.
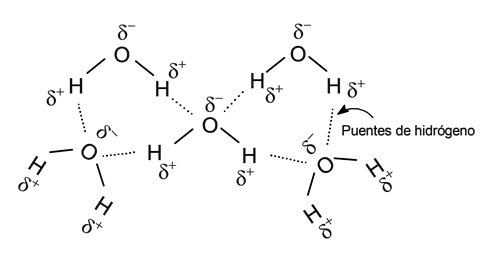
- É incompressível . Não é possível reduzir o volume da água aplicando pressão, pois as moléculas de água permanecem interconectadas, mantendo suas distâncias intermoleculares de forma fixa.
- Sua tensão superficial é alta . A superfície da água oferece resistência se alguém tentar aumentá-la ou quebrá-la. Isso tem uma implicação prática muito significativa: a água permite a suspensão e o arrastamento de microrganismos , partículas grossas e moléculas insolúveis.
- Tem capilaridade . Devido à sua tendência à coesão e aderência às superfícies, a água pode subir através de tubos de diâmetro muito pequeno chamados “capilares”. Esse fenômeno explica em parte por que a água que leva uma árvore até o solo pode chegar ao topo, ou por que um cano que atravessa o chão de uma casa pode causar umidade na parede acima dela.
- Possui ação solvente . Devido à sua natureza bipolar, a água é um ótimo solvente para substâncias polares, como sais , ácidos , bases .
- Possui alto calor específico . Essa propriedade requer muita energia para elevar a temperatura de um corpo d’água, certamente mais do que para elevar a temperatura do ar . Isso explica sua capacidade de regular o clima : nas zonas costeiras as noites são mais frescas porque o sol não consegue aquecer a água e o ar. Na prática, a água é o refrigerante líquido mais barato para qualquer dispositivo.

Algumas reações químicas da água
- Reage com óxidos ácidos . Os anidridos ou óxidos ácidos reagem com a água para formar ácidos oxoácidos. É o que ocorre, por exemplo, quando a água reage com o dióxido de carbono (CO 2 ) ou dióxido de nitrogênio (NO 2 ), que gera ácido carbônico (H 2 CO 3 ) ou ácido nítrico (HNO 3 ), respectivamente.
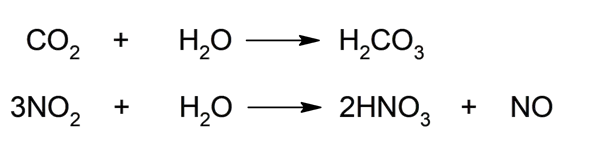
- Ele pode reagir com óxidos básicos . Quando a água reage com os óxidos básicos, ou seja, os óxidos metálicos (como o cálcio (Ca) ou o magnésio (Mg)), ela gera os hidróxidos correspondentes. Quando reage com não metais , como halogênios em sua forma molecular (diatômica), resulta em hidrácidos, por exemplo ácido clorídrico (HCl (aq) ).
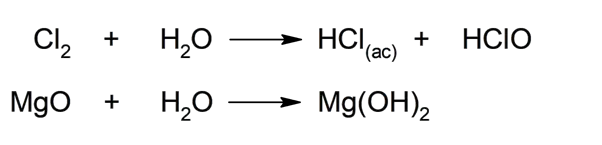
- Pode produzir a hidratação de sais . Muitos sais são comercializados no estado hidratado (por exemplo, sulfato ferroso hidratado com sete moléculas de água ou heptahidratado (FeSO 4 * 7H 2 O)), pois assim são mais solúveis e, portanto, mais fáceis de usar. No entanto, também deve ser levado em consideração que a hidratação de um sal pode ser um fenômeno indesejado, mas que ocorre em decorrência de sua alta hidrofilicidade. Essas substâncias que tendem a reter água são chamadas de “higroscópicas” e podem ser usadas como agentes desidratantes ou secantes. O caso mais conhecido neste sentido é o da sílica-gel.

Pode servir a você: Hidrocarbonetos