Explicamos o que são as forças intermoleculares e como são classificadas. Além disso, quais são suas características gerais e alguns exemplos.

O que são forças intermoleculares?
As forças intermoleculares são denominadas o conjunto de forças atrativas e repulsivas que ocorrem entre as moléculas da matéria , geralmente devido à presença e distribuição de seus elétrons (polaridade).
Essas forças ocorrem na natureza e fazem parte dos elementos e processos envolvidos na ligação entre átomos e moléculas para chegar a estruturas mais complexas , que podem ocorrer por meio de vários tipos de processos, que por sua vez envolvem diferentes tipos de forças.
Assim, forças intermoleculares ocorrem entre moléculas de natureza diversa , determinando muitas das propriedades físicas da substância resultante, como seu estado de agregação , pontos de fusão e ebulição, solubilidade, densidade, etc.
Veja também: Coloides
Importância das forças intermoleculares
As forças intermoleculares são forças fundamentais para a construção de estruturas moleculares complexas , como as necessárias à vida ou para formar substâncias inorgânicas de vários tipos.
Além disso, muitas propriedades físicas da substância resultante dependem de forças intermoleculares, uma vez que determinam o quanto as partículas mínimas de uma substância se atraem.
O que é uma ligação química?

Uma ligação química é o processo no qual dois ou mais átomos se unem para formar um composto químico. Isso torna a estrutura resultante mais estável do que os átomos sozinhos. Existem duas classificações de ligações químicas:
- Ligações covalentes . Eles são ligações químicas nas quais dois átomos compartilham elétrons de sua camada externa para formar um composto estável.
- Não covalente . Consideradas “interações fracas” ou de baixa energia, elas mantêm moléculas, íons e partes de moléculas juntas. Essas ligações ocorrem por vários tipos de forças: ligações de hidrogênio , forças de Van der Waals ou forças de dispersão de Londres.
Tipos de forças intermoleculares
Forças íon-íon
Eles ocorrem entre moléculas ou átomos eletricamente carregados (cátion se a carga for positiva, ânion se for negativo), de acordo com a regra fundamental de que íons com cargas iguais se repelem e com cargas diferentes se atraem.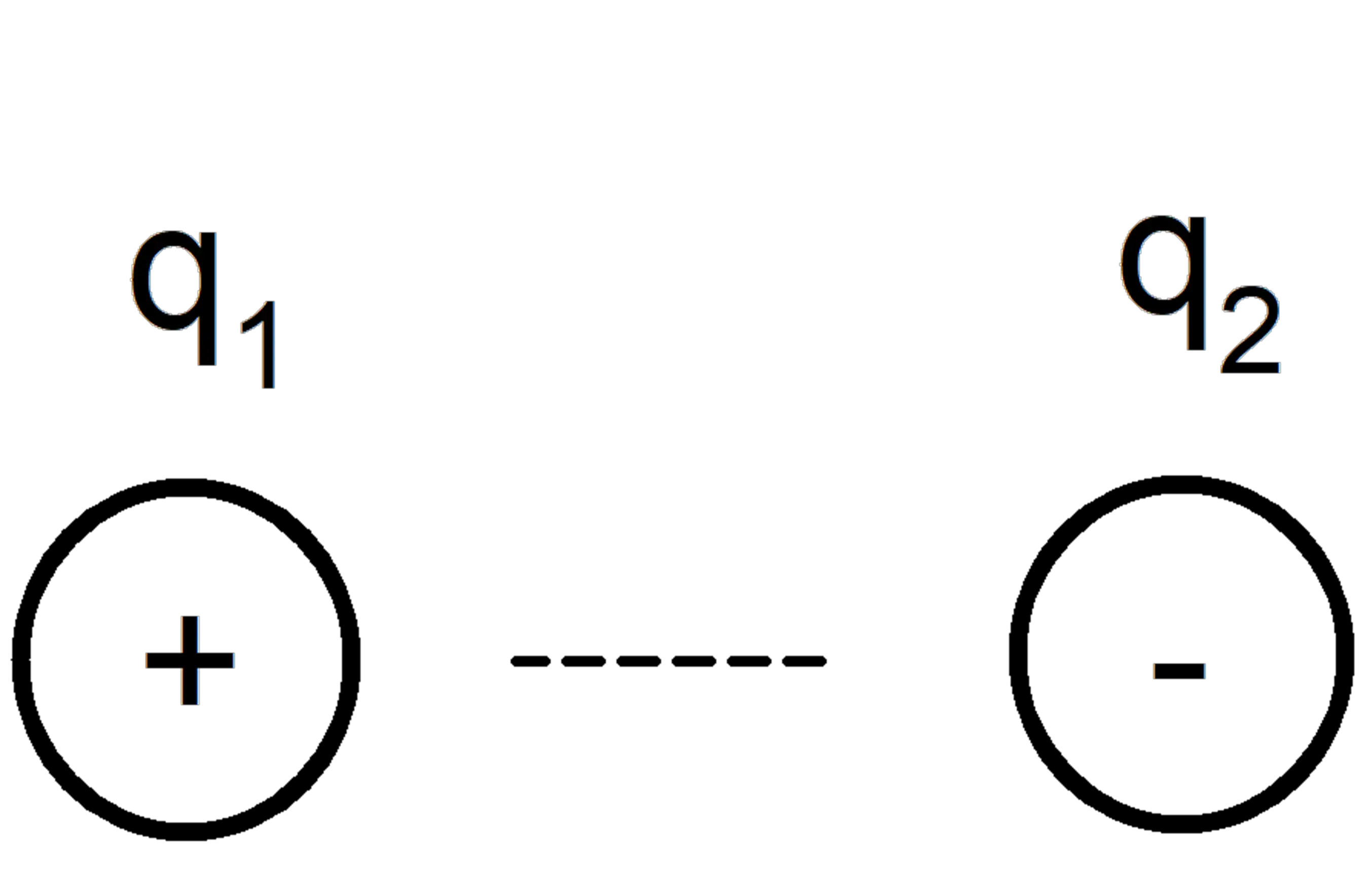
Forças íon-dipolo

Eles são forças atrativas entre um íon (um átomo carregado) e uma molécula polar . O dipolo (gerado na molécula polar) se junta ao íon através de sua extremidade com uma carga oposta à do íon, com uma intensidade proporcional à carga do íon.
Muitos dipolos podem ser colocados juntos dessa maneira, se o íon for grande o suficiente. Essas são as forças envolvidas na dissolução de sais , por exemplo.
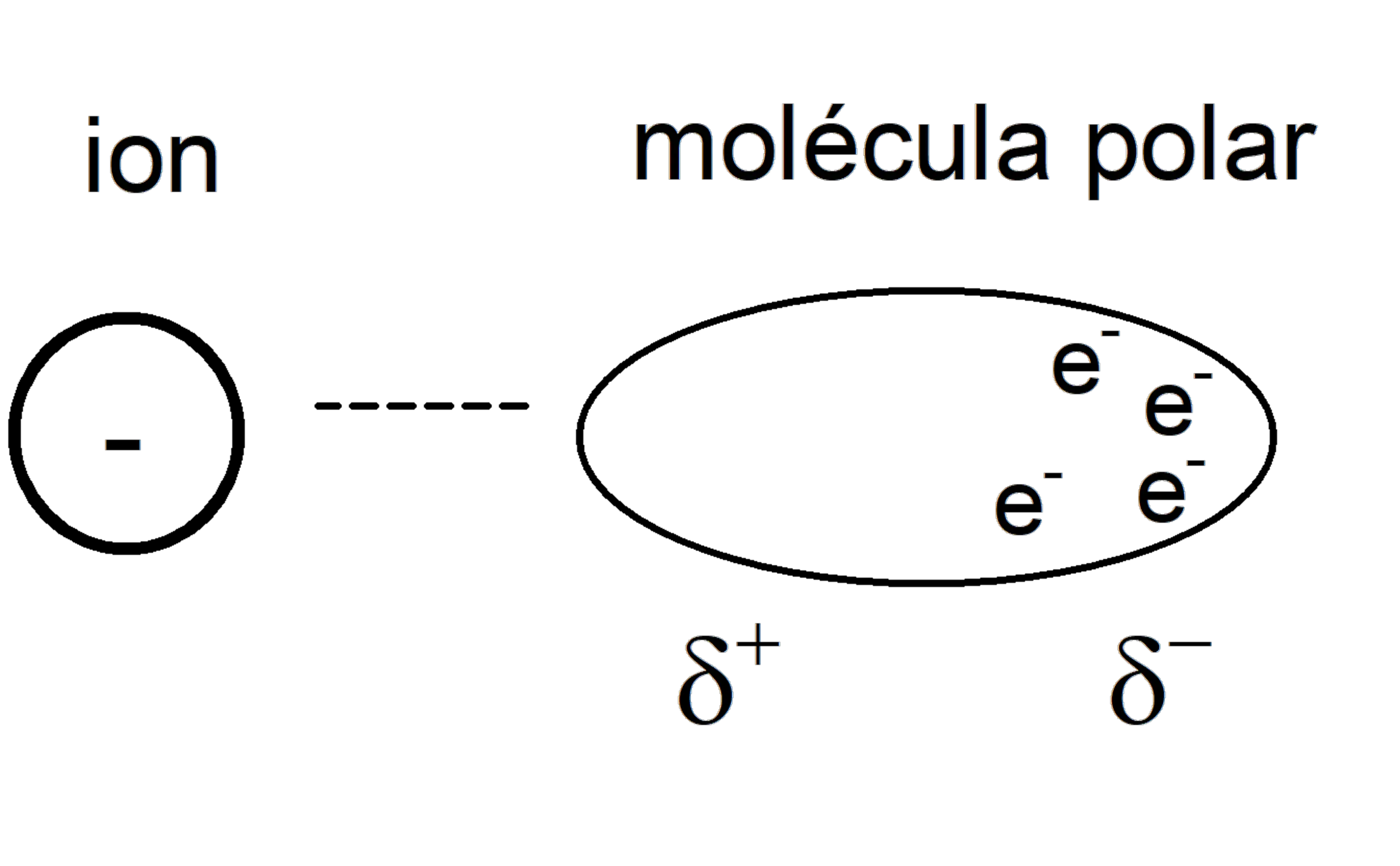
Forças íon-dipolo induzidas
Muito semelhante ao caso do íon e da molécula polar, mas em vez desta última, é uma molécula apolar em que um dipolo é induzido pelo campo eletrostático do íon , adquirindo polaridade instantânea, mas de baixa intensidade.
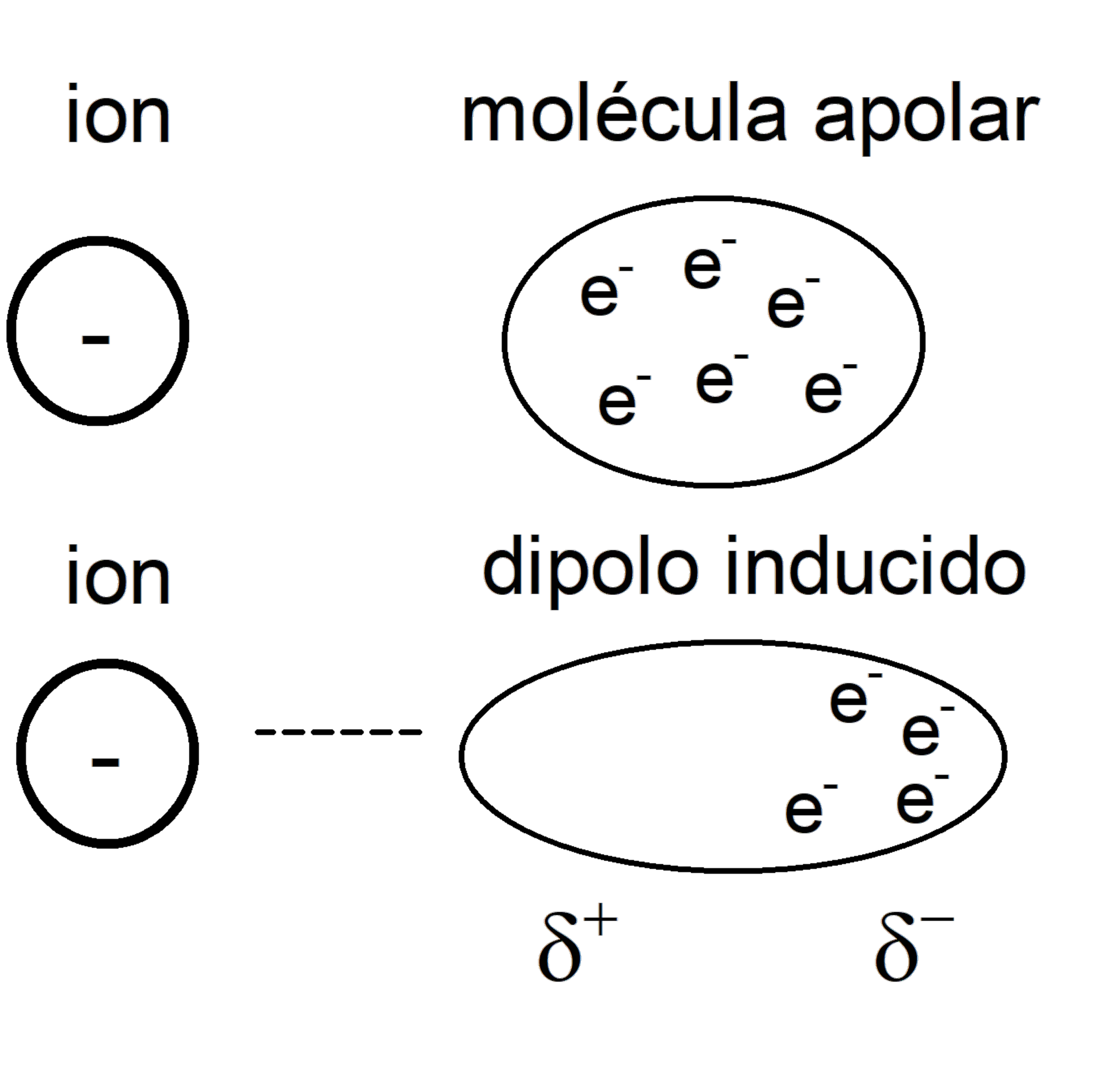
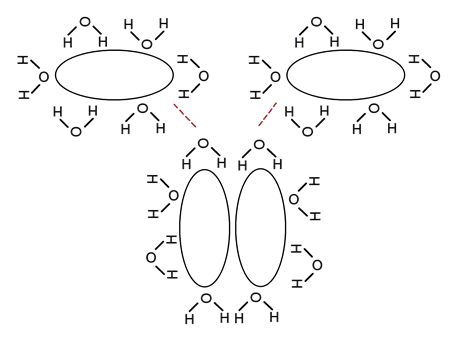
Forças hidrofóbicas
É o nome dado às forças repulsivas que certas moléculas apresentam na água , como é o caso de muitos lipídios.
Essas moléculas, em seu esforço para minimizar a superfície que interage com um meio aquoso, se organizam em agregados supramoleculares.
Esses tipos de construções moleculares são fundamentais para a vida, pois em muitos casos permitem a construção de membranas biológicas.
Ligações de hidrogênio
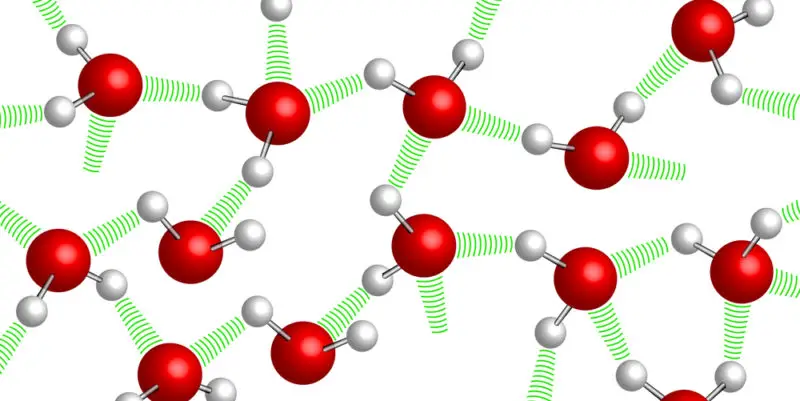
A ligação de hidrogênio ocorre quando um átomo de hidrogênio em um composto químico se liga a outro fortemente eletronegativo , como nitrogênio , oxigênio ou flúor.
Isso deixa o hidrogênio com uma leve carga eletropositiva parcial, o suficiente para interagir novamente com outros átomos eletronegativos (os mesmos N, O e F) de outra molécula, agindo como uma ponte ou ligação entre os dois.
Essas ligações serão mais fortes quanto mais eletronegativo for o átomo ligado ao hidrogênio.
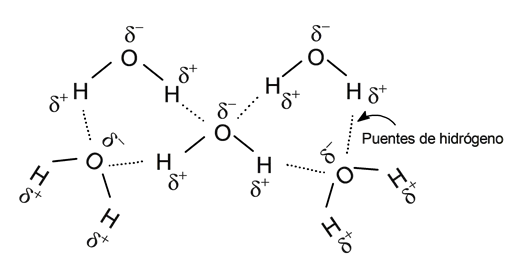
Forças de Van der Waals
É conhecida por este nome certas forças atrativas e / ou repulsivas entre moléculas que não têm a ver com ligações intramoleculares (covalentes, iônicas, metálicas) mas com sua natureza eletromagnética ou polar em casos muito específicos. As forças de Van der Waals são:
- Forças dipolo-dipolo . Essas são forças entre dois dipolos permanentes, conhecidas como forças de Keesom. Essas interações ocorrem entre moléculas polares, que possuem um pólo positivo (densidade de carga + ) e um pólo negativo ( densidade de carga – ), de forma que o pólo positivo interage com o pólo negativo. Para quebrá-los, é necessário introduzir mais energia do que seria necessário para separar as moléculas não polares. As ligações de hidrogênio são freqüentemente consideradas um exemplo disso.
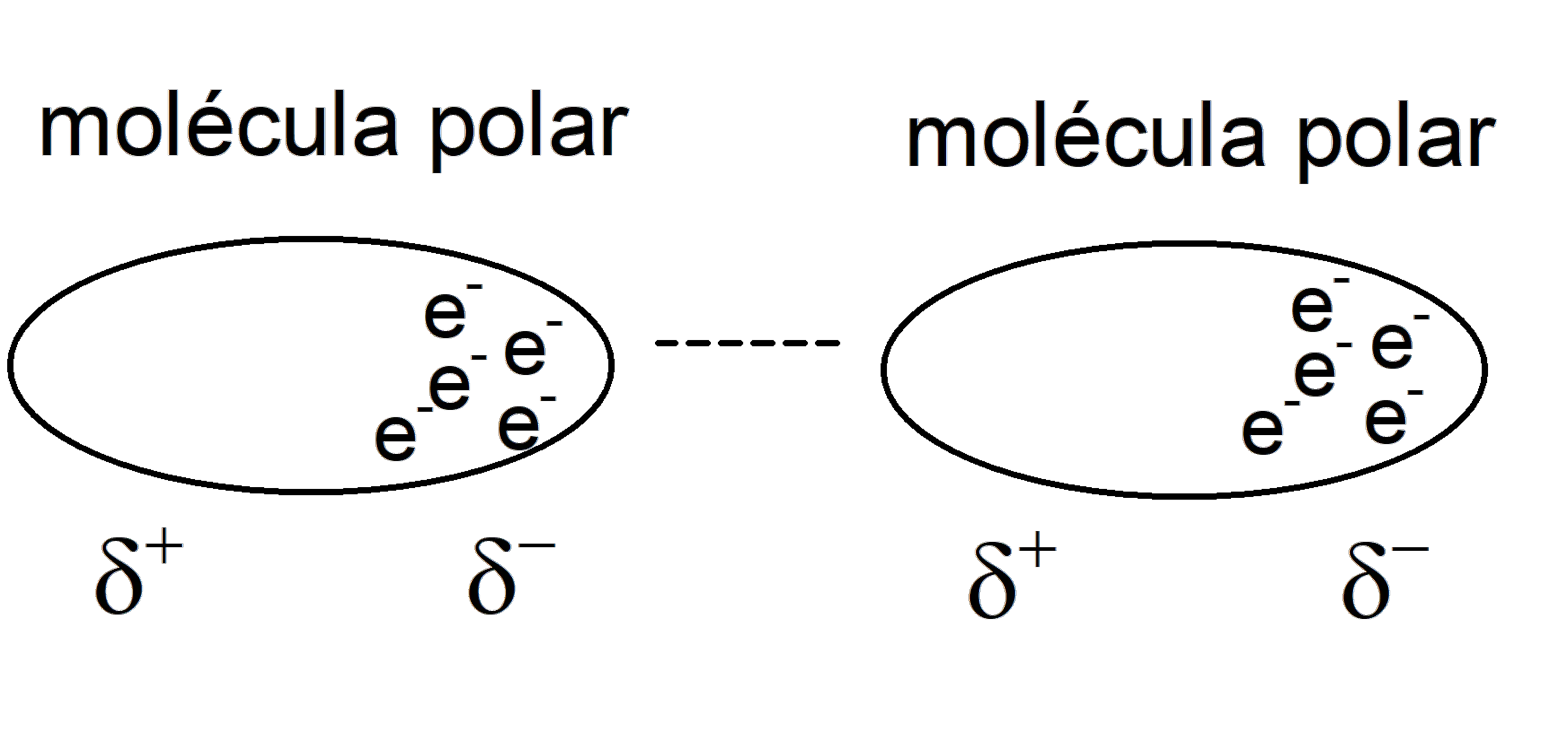
- Forças dipolo-dipolo induzidas . São forças geradas quando um dipolo induz um dipolo em uma molécula apolar, portanto, são interações que ocorrem entre as moléculas polares e apolares. Então, esse dipolo induzido pode interagir com outro dipolo, como se fossem forças de Keesom. Por esta razão, por exemplo, gases não polares (como Cl) podem ser dissolvidos em solventes polares.
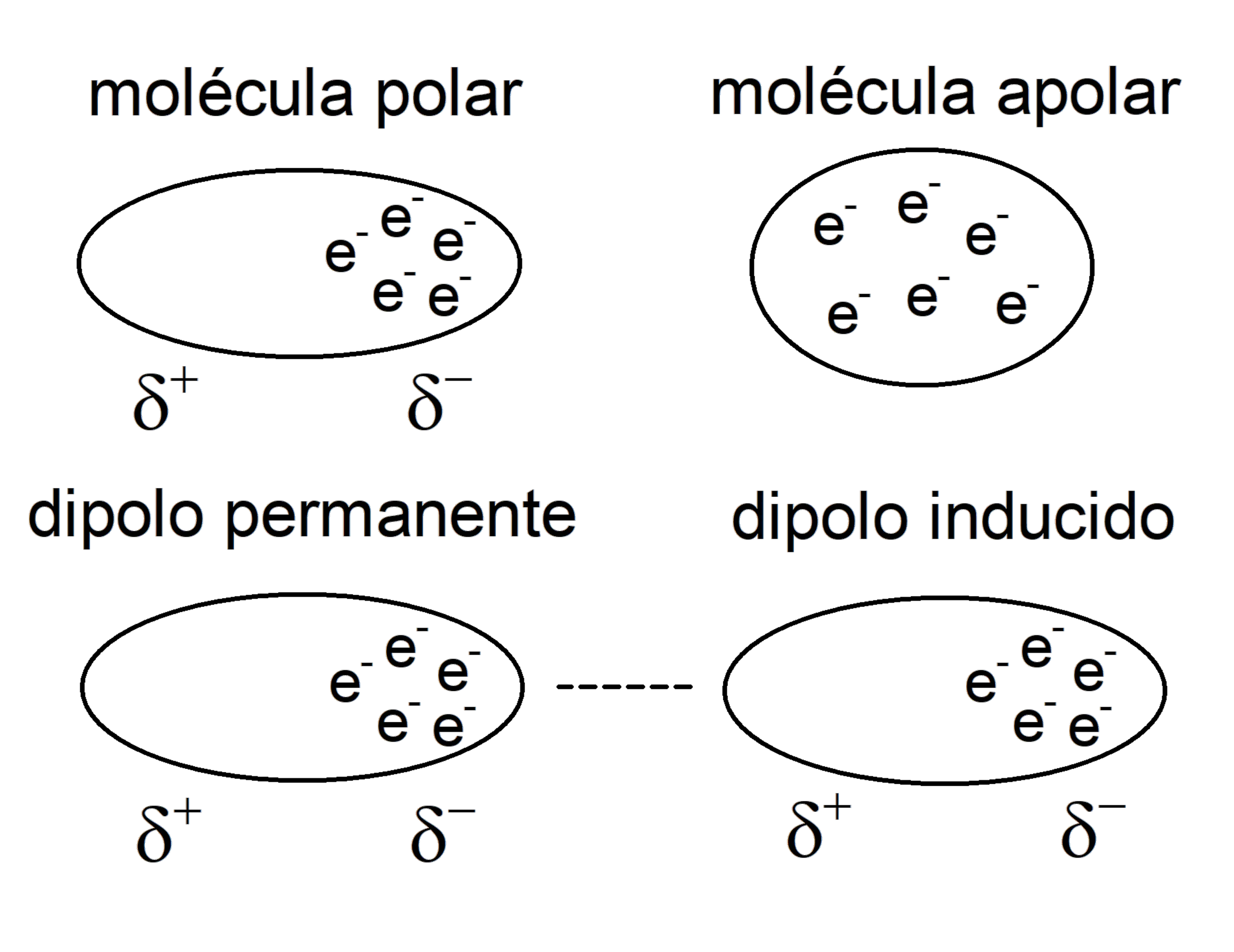
Forças de dispersão de Londres
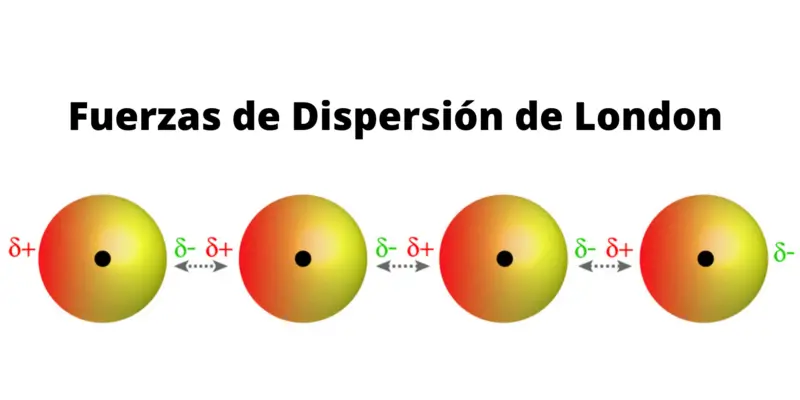
Frequentemente consideradas entre as forças de Van der Waals (e chamadas de forças dipolo induzidas por dipolo instantâneas), elas ocorrem apenas entre moléculas apolares que, ao se aproximarem, sofrem uma distorção em suas nuvens de elétrons e produzem reciprocamente dipolos induzidos por transientes.
Isso permitirá que eles se juntem, por meio de suas extremidades eletricamente opostas , com uma força proporcional à quantidade de elétrons que apresentam e que, portanto, foram distribuídos de outra maneira.

Exemplos de compostos que possuem forças moleculares
- Membranas celulares . A dupla camada de lipídios que envolve nossas células funciona com base em forças hidrofóbicas, que ordenam todos os lipídios da mesma forma, com suas cabeças hidrofílicas voltadas para fora e seus corpos hidrofóbicos voltados para o interior da célula.
- Cadeias de DNA . A dupla hélice do DNA é mantida unida por ligações de hidrogênio que lhe dão sua estrutura fixa habitual.
- Enzimas . Eles reagem aos seus substratos, atraídos por uma força íon-íon que garante uma atração forte e permanente.
- Dissolução de sais . Por exemplo, o cloreto de sódio (NaCl) possui cargas elétricas de seus íons (Na + e Cl – ) que interagem com as densidades de cargas elétricas do dipolo de água, formando interações íon-dipolo.
Continue com: Polímeros