Explicamos o que são alcanos, os usos e propriedades desses hidrocarbonetos e suas características gerais.

O que são alcanos?
Os alcanos constituem uma das principais famílias de hidrocarbonetos (compostos orgânicos constituídos por átomos de carbono e hidrogênio).
Os alcanos são muito importantes como combustíveis domésticos e industriais, pois são utilizados para o funcionamento de caldeiras, turbo geradores e fogões a gás, entre outros. São também insumos em diversos setores como vidro , têxtil e plástico .
Veja também: Química Orgânica
Tipos de alcanos
Os alcanos podem ser alifáticos ou cicloalcanos.
- Alcanos alifáticos . Também chamado de parafinas, eles têm uma estrutura linear e obedecer à fórmula geral C n H 2n + 2 , em que n representa o número ou a quantidade de átomos de carbono no composto (que contêm mais do que duas vezes como muitos hidrogénio átomos como átomos de carbono )
- Cicloalcanos . Eles têm uma estrutura em forma de ciclo e sua fórmula geral é C n H 2n .
Características dos alcanos

- Eles estão associados a seres vivos . Embora os alcanos não sejam materiais essenciais para os seres vivos , eles freqüentemente aparecem como produtos intermediários ou finais do metabolismo microbiano. É o caso, por exemplo, da fermentação metanogênica realizada por bactérias no rúmen dos animais.
- Alguns alcanos, como o metano (CH 4 ), podem ser inflamáveis, explosivos ou tóxicos , portanto, devem ser manuseados com extremo cuidado.
- Eles são hidrocarbonetos saturados porque as ligações entre os átomos de carbono são simples e estáveis. Isso os diferencia de alcenos e alcinos, que se caracterizam por terem ligações duplas e triplas, respectivamente, entre seus átomos de carbono . Por exemplo:
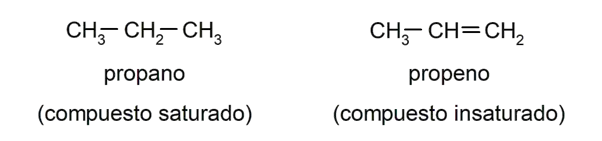
- Eles podem ter substituintes . Os átomos de hidrogênio ligados a cada átomo de carbono podem ser substituídos por outros átomos, como halogênios (flúor, bromo, cloro) ou vários grupos ou “radicais” (grupos hidroxila (OH – ) e metil (CH 3 -) são muito comuns. ) Neste último caso, a estrutura torna-se mais complexa, dando origem a alcanos ramificados. Por exemplo:
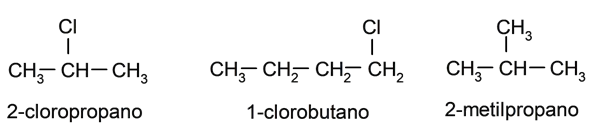
- Eles podem formar estruturas fechadas . Os átomos de carbono estão ligados entre si dando origem à formação de cadeias, mas as extremidades dessas cadeias podem se combinar e formar os chamados alcanos cíclicos, como no caso do ciclohexano, ciclopentano e ciclobutano.

Propriedades físicas de alcanos

As propriedades físicas dos alcanos são amplamente determinadas pelo número de átomos de carbono que eles contêm em sua estrutura . Por exemplo, alcanos que têm entre 1 e 4 átomos de carbono são gases à temperatura ambiente; aqueles com 5 a 17 átomos de carbono são líquidos na mesma temperatura, e aqueles com 18 ou mais carbonos são sólidos na temperatura ambiente.
- Baixa solubilidade . Em geral, os alcanos são pouco ou não solúveis em água e , à medida que o peso molecular aumenta, a solubilidade torna-se ainda mais baixa. Em solventes orgânicos, entretanto, a solubilidade é alta.
- Baixa densidade . Sua densidade é menor que a da água, por isso tendem a flutuar. Isso parece ótimo quando ocorrem derramamentos de óleo no mar , como derramamentos de óleo (mistura de muitos hidrocarbonetos). Por outro lado, a densidade dos alcanos aumenta à medida que aumenta sua massa molecular, ou seja, o número de átomos de carbono.
- Ponto de fusão e ebulição variável . O ponto de fusão e ebulição depende do número de átomos de carbono (quanto maior o número, maior o ponto de fusão e o ponto de ebulição), mas também da estrutura: as estruturas lineares têm um ponto de fusão e ebulição mais alto do que as ramificadas. O ponto de ebulição dos alcanos aumenta em aproximadamente 30 ° C cada vez que um átomo de carbono é adicionado ao composto.
- Condutividade elétrica . Alcanos geralmente não conduzem eletricidade .
Reações químicas de alcanos
As reações mais comuns que os alcanos podem sofrer são:
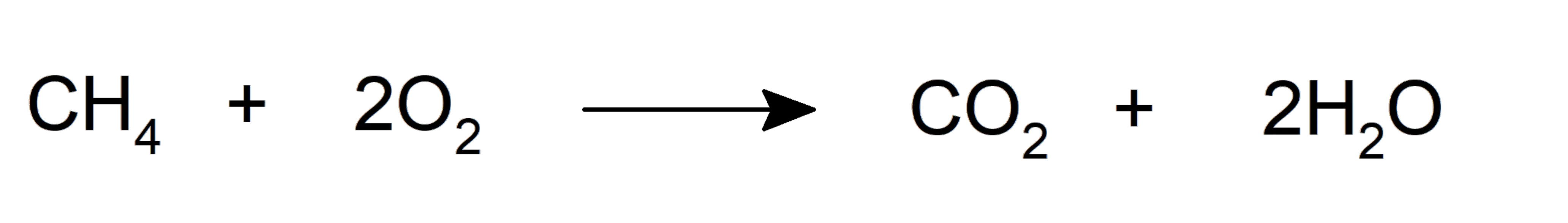
- Oxidação . Quando combinados com o oxigênio, podem formar dióxido de carbono e água e liberar energia na forma de calor. Esta é a reação de combustão típica.
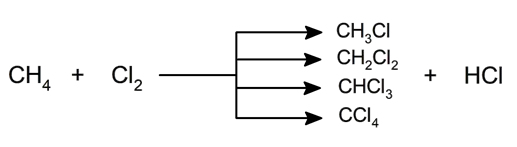
- Halogenação . Cloro, bromo, flúor e iodo podem substituir átomos de hidrogênio no alcano. Os produtos da reação consistem em diferentes proporções de diferentes alcanos halogenados. Um exemplo é o clorofórmio, que é um hidrocarboneto halogenado (triclorometano).
- Nitração . Em altas temperaturas e na presença de vapores de ácido nítrico, pode ocorrer a substituição do hidrogênio pelo grupo NO 2 – , o que gera nitroalcanos em diferentes proporções.
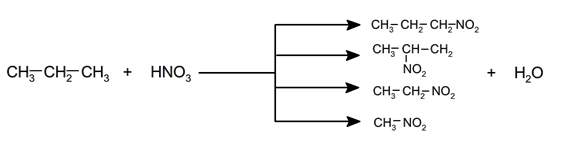
- Isomerização . É a reestruturação da molécula sem perda ou ganho de átomos. Geralmente, essa reação requer o uso de catalisadores. Por exemplo:
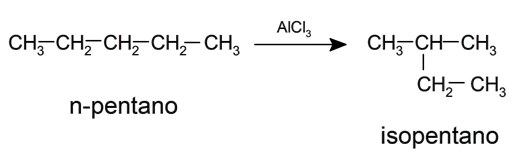
- Pirólise . É a decomposição dos alcanos por exposição a uma temperatura muito elevada e sem a presença de ar , evitando assim a sua combustão e priorizando a decomposição das moléculas quebrando as suas ligações químicas . Esta reação é usada na indústria para obter alcenos de cadeia curta e alcanos de alcanos de cadeia mais longa.
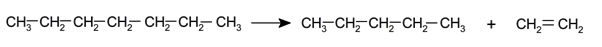
Pode ajudá-lo: Compostos orgânicos
