Explicamos o que são os estados sólido, líquido e gasoso e as propriedades que eles possuem. Além disso, suas características e exemplos.
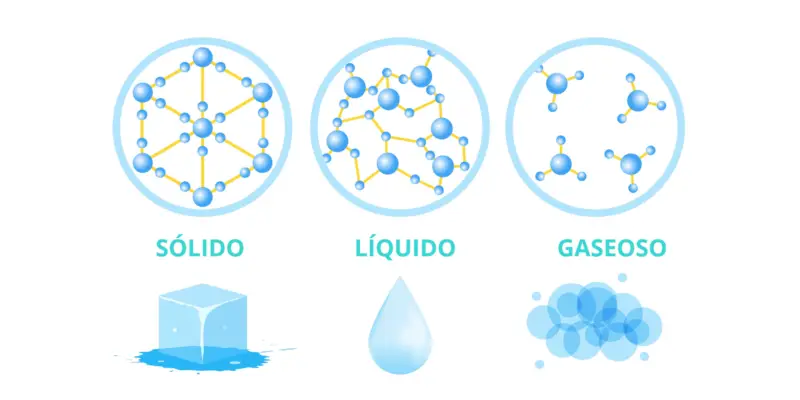
Quais são os estados sólido, líquido e gasoso?
Quando falamos em estados de agregação da matéria , trata-se das formas como a matéria pode se apresentar , dependendo da relação entre as partículas que a compõem. Geralmente três são conhecidas, também chamadas de fases: o estado sólido, o líquido e o gasoso.
Esta configuração determina diferentes propriedades físicas da matéria . Embora as substâncias sejam quimicamente idênticas, as diferenças físicas são drásticas. Isso pode ser observado, por exemplo , na água líquida, no estado sólido (gelo) ou no estado gasoso (vapor).
Existem também outros menos frequentes . Entre eles estão o estado plasmático ou supersólido, mas essas formas não ocorrem espontaneamente na natureza, mas em laboratórios.
Veja também: Misturas
Estado sólido

A matéria em estado sólido apresenta suas partículas muito unidas por forças atrativas de grande intensidade.
Ou seja, as partículas estão muito próximas umas das outras e vibram lentamente .
Eles se comportam como um único corpo, com grande coesão , maior densidade do que outros estados e forma constante.
Os corpos sólidos são resistentes à fragmentação e são dotados de memória de forma, ou seja, tendem a permanecer sempre os mesmos.
Os sólidos têm pouca ou nenhuma fluidez porque, antes de mais nada , mantêm a sua forma. Em geral, eles não podem ser comprimidos, pois suas partículas estão o mais próximas possível. Quando são quebrados ou fragmentados, novos objetos sólidos de menor tamanho são obtidos.
Seguir em: estado sólido
Tipos de sólidos e exemplos

Existem dois tipos de sólidos, de acordo com a forma como suas partículas estão dispostas:
- Cristalino. Eles são formados por células organizadas de forma geométrica, de modo que geralmente têm uma forma regular e precisa, baseada em um padrão.
- Amorfo ou vítreo. Como suas partículas não se juntam em uma estrutura ordenada ou em um certo padrão, sua forma é frequentemente irregular e variada, dependendo das condições em que foram produzidas.
Alguns exemplos de sólidos são: minerais, metais , ossos, madeira , vidro .
O estado líquido

No caso dos líquidos, suas partículas ainda são mantidas juntas por forças atrativas, mas estas são muito mais fracas e desordenadas do que as dos sólidos . Por esse motivo, os líquidos não conseguem manter uma forma fixa ou estável, nem apresentam tanta coesão e resistência.
Assim, obtêm a forma do recipiente que os contém e possuem grande fluidez, de fato, podem ser inseridos e extraídos através de pequenos espaços. A tensão superficial que os faz aderir aos objetos, é por isso que a água se molha.
Os líquidos são pouco compressíveis e têm volume próprio . Além disso, com exceção da água, eles tendem a se contrair quando resfriados.
Tipos de líquidos e exemplos

Os líquidos são classificados de acordo com sua fidelidade aos princípios físicos descritos por Isaac Newton em seus estudos sobre viscosidade. Pode ser:
- Fluidos Newtonianos. Eles atendem às expectativas de Newton, mantendo sua viscosidade constante. Esses são os fluidos mais simples de descrever; quanto mais densos eles são, mais devagar eles fluem.
- Fluidos não newtonianos. É um tipo especial de fluido que não obedece às equações de Newton, pois sua viscosidade ou oposição ao escoamento depende de fatores externos (da força que lhe é aplicada), portanto, apresentam apenas uma viscosidade aparente. Esses fluidos quase sempre são obtidos artificialmente.
Exemplos de líquidos são: água, mercúrio , sangue , café , álcool, alcatrão.
O estado gasoso

As partículas de gás estão em um estado de dispersão e distância tão caótico que dificilmente se mantêm juntas. A força de atração entre eles é fraca, então os gases ocupam um volume muito maior do que os líquidos e sólidos.
As substâncias no estado gasoso tendem a se expandir até ocupar todo o espaço que as contém. Os gases também carecem de uma forma fixa e também de um volume fixo e respondem muito pouco à gravidade .
Mais em: Estado gasoso
Tipos de gás e exemplos

Os gases são geralmente classificados de acordo com suas propriedades químicas, que podem ser muito diversas, por exemplo:
- Gases inertes. Aqueles dotados de muito pouca reatividade química, como gases nobres .
- Gases inflamáveis. Aqueles de fácil combustão na presença de oxigênio e calor, produzindo reações explosivas e exotérmicas.
- Gases corrosivos. Aqueles que têm capacidade inata de gerar corrosão, ou seja, cujo pH é tão ácido ou tão básico que causam danos às superfícies por contato.
- Gases ideais . É o nome dado aos gases cujo comportamento físico é ideal, ou seja, imaginário, teórico. Eles são uma abstração para o estudo de gases.
Alguns exemplos simples de gases são: ar , metano (CH 4 ), dióxido de carbono (CO 2 ), ozônio (O 3 ) e hélio (He).
A fase muda para sólida
Mudanças de fase são as operações físicas que convertem a matéria de um estado para outro, sem geralmente alterar suas propriedades químicas. Os seguintes são os que convertem matéria em sólido:
- Solidificação. Ao retirar a energia térmica (que pode ser feita com a aplicação de frio), faz-se a aproximação e desaceleração das partículas de um líquido, permitindo-lhes construir estruturas mais fortes e resistentes, típicas de um sólido. Isso é o que acontece quando a água congela.
- Deposição ou cristalização. Da mesma forma, quando a energia térmica é retirada de um gás, pode-se fazer que, sob certas condições de pressão, suas partículas se aglutinem e percam sua enorme velocidade, transformando-se em cristais sólidos sem antes passar pelo estado líquido. É também conhecida como Sublimação Reversa e geralmente ocorre no topo das montanhas , sempre coberta de gelo.
Mudanças de fase para líquido

Os processos de mudança de fase que levam ao líquido são:
- Fusão. É o processo oposto à solidificação: a energia térmica é adicionada à matéria sólida, fazendo com que suas partículas ganhem movimento e velocidade, até que derreta, flua e se torne líquida. Ele permanece neste estado pelo menos enquanto for mantido a uma determinada temperatura. É o que se faz na metalurgia com o ferro .
- Liquefação. Ocorre quando um gás é submetido a pressões muito altas, forçando-o a se tornar líquido, sem alterar sua temperatura . É assim que os gases liquefeitos são obtidos, como o butano líquido e o metano.
- Condensação. Novamente, remover calor (ou adicionar frio) a um gás faz com que suas partículas se movam mais lentamente e abram mão de sua própria atração, formando gotas de líquido em qualquer superfície. É o que acontece com o vapor d’água no espelho quando tomamos banho.
Mudança de fase para gasosa
Por fim, as mudanças de fase que levam ao estado gasoso são:
- Vaporização ou evaporação. É produzido pela introdução de energia térmica em um líquido além de seu ponto de evaporação: suas partículas começam a vibrar muito mais rapidamente e o espaço entre elas aumenta, transformando a matéria em um gás. Podemos verificar isso fervendo água na cozinha.
- Sublimação. Sob certas condições de pressão e temperatura, é possível mover rapidamente as partículas de um sólido, a ponto de se tornar um gás diretamente, sem antes passar pelo estado líquido. Isso ocorre com gelo seco (gelo CO 2 ) em temperatura ambiente.
Estado de plasma

Um quarto estado de agregação da matéria , que consiste em um gás ionizado, é conhecido como plasma . Este é um gás cujos átomos têm elétrons removidos e, portanto, têm uma carga elétrica fixa (ânions + e cátions -). Por isso, o plasma é um excelente transmissor de eletricidade .
Além disso, existem dois tipos de plasma:
- Plasma frio. Eles estão em temperatura ambiente, uma vez que apenas elétrons são carregados de energia.
- Plasma quente. Seus átomos ionizados ficam extremamente quentes, gerando luz e calor.
Alguns exemplos de plasma são o Sol , telas eletrônicas ou dentro de tubos de iluminação fluorescente (como o néon).